Flavin mononukleotid
| Flavin mononukleotid | |||
|---|---|---|---|
 | |||
| Drugi nazivi | FMN | ||
| Identifikacija | |||
| CAS registarski broj | 146-17-8  Y Y | ||
| PubChem[1][2] | 643976 | ||
| ChemSpider[3] | 559060  Y Y | ||
| UNII | 7N464URE7E  Y Y | ||
| MeSH | Flavin+mononucleotide | ||
| ChEBI | 17621 | ||
| ChEMBL[4] | CHEMBL1201794  Y Y | ||
| Jmol-3D slike | Slika 1 | ||
| |||
| |||
| Svojstva | |||
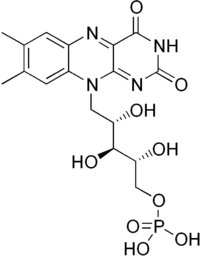
| Molekulska formula | C17H21N4O9P | ||
| Molarna masa | 456,344 g/mol | ||
| Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje (25 °C, 100 kPa) materijala | |||
| Infobox references | |||
Flavin mononukleotid (FMN, riboflavin-5′-fosfat) je biomolekul koji se formira iz riboflavina (vitamina B2) enzimom riboflavin kinaza i funkcioniše kao prostetska grupa raznih oksidoreduktaza među kojima je NADH dehidrogenaza, kao i kofaktor bioloških foto receptora plavog-svetla. Tokom katalitičkog ciklusa, reverzibilna interkonversija oksidizovanih (FMN), semihinonskih (FMNH•) i redukovanih (FMNH2) formi se odvija u raznim oksidoreduktazama. FMN je jači oksidicioni agens nego NAD i posebno je koristan zato što učestvuje u jedno- i dvo-elektronskim transferima.[5] U njegovoj ulozi foto receptora plavog svetla, (oksidovani) FMN se izdvaja od konvencionalnih foto receptora po tome što je signalno stanje a ne E/Z izomerizacija.[6]
Vidi još
- FAD
- NAD
Literatura
- Nicholas C. Price, Lewis Stevens (1999). Fundamentals of Enzymology: The Cell and Molecular Biology of Catalytic Proteins (Third izd.). USA: Oxford University Press. ISBN 019850229X.
- Eric J. Toone (2006). Advances in Enzymology and Related Areas of Molecular Biology, Protein Evolution (Volume 75 izd.). Wiley-Interscience. ISBN 0471205036.
- Branden C, Tooze J.. Introduction to Protein Structure. New York, NY: Garland Publishing. ISBN: 0-8153-2305-0.
- Irwin H. Segel. Enzyme Kinetics: Behavior and Analysis of Rapid Equilibrium and Steady-State Enzyme Systems (Book 44 izd.). Wiley Classics Library. ISBN 0471303097.
- William P. Jencks (1987). Catalysis in Chemistry and Enzymology. Dover Publications. ISBN 0486654605.
- ↑ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today 15 (23-24): 1052-7. DOI:10.1016/j.drudis.2010.10.003. PMID 20970519. edit
- ↑ Evan E. Bolton, Yanli Wang, Paul A. Thiessen, Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry 4: 217-241. DOI:10.1016/S1574-1400(08)00012-1.
- ↑ Hettne KM, Williams AJ, van Mulligen EM, Kleinjans J, Tkachenko V, Kors JA. (2010). „Automatic vs. manual curation of a multi-source chemical dictionary: the impact on text mining”. J Cheminform 2 (1): 3. DOI:10.1186/1758-2946-2-3. PMID 20331846. edit
- ↑ Gaulton A, Bellis LJ, Bento AP, Chambers J, Davies M, Hersey A, Light Y, McGlinchey S, Michalovich D, Al-Lazikani B, Overington JP. (2012). „ChEMBL: a large-scale bioactivity database for drug discovery”. Nucleic Acids Res 40 (Database issue): D1100-7. DOI:10.1093/nar/gkr777. PMID 21948594. edit
- ↑ Donald Voet, Judith G. Voet (2005). Biochemistry (3 izd.). Wiley. ISBN 978-0-471-19350-0.
- ↑ Z. Cao, V. Buttani, A. Losi and W. Gärtner (2008). „A Blue Light Inducible Two-Component Signal Transduction System in the Plant Pathogen Pseudomonas syringae pv. tomato”. Biophysical Journal 94 (3): 897-905. DOI:10.1529/biophysj.107.108977.
Spoljašnje veze
 | Portal Hemija |
- FMN
- p
- r
- u
TPP / ThDP (B1) • FMN, FAD (B2) • NAD+, NADH, NADP+, NADPH (B3) • Koenzim A (B5) • PLP / P5P (B6) • Biotin (B7) • THFA / H4FA, DHFA / H2FA, MTHF (B9) • AdoCbl, MeCbl (B12) • Askorbinska kiselina (C) • Filohinon (K1), Menahinon (K2) • Koenzim F420 | |
ne-vitaminski | ATP • CTP • SAMe • PAPS • GSH • Koenzim B • Kofaktor F430 • Koenzim M • Koenzim Q • Hem (A, B, C, O) • Lipoinska kiselina • Metanofuran • Molibdopterin/Molibdenski kofaktor • PQQ • THB / BH4 • THMPT / H4MPT |
| |||||







