Fluorin
9F Fluorin | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Fluorin cair (pada suhu yang sangat rendah) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Garis spektrum fluorin | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sifat umum | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nama, lambang | fluorin, F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pengucapan | /fluorin/[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Alotrop | alfa, beta (lihat alotrop fluorin) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Penampilan | gas: kuning sangat pucat cairan: kuning cerah padatan: alfa buram, beta transparan | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fluorin dalam tabel periodik | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 9F
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nomor atom (Z) | 9 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Golongan | golongan 17 (halogen) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Periode | periode 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Blok | blok-p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kategori unsur | nonlogam diatomik | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Berat atom standar (Ar) |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Konfigurasi elektron | 1s2 2s2 2p5[2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektron per kelopak | 2, 7[2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sifat fisik | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fase pada STS (0 °C dan 101,325 kPa) | gas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Titik lebur | (F2) 53,48 K (−219,67 °C, −363,41 °F)[3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Titik didih | (F2) 85,03 K (−188,11 °C, −306,60 °F)[3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kerapatan (pada STS) | 1,696[4] g/L | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| saat cair, pada t.d. | 1,505 g/cm3[5] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Titik tripel | 53,48 K, 90 kPa[3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Titik kritis | 144,41 K, 5,1724 MPa[3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kalor peleburan | 0,51 kJ/mol[6] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kalor penguapan | 6,51 kJ/mol[7] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kapasitas kalor molar | Cp: 31 J/(mol·K)[8] (suhu 21,1 °C) Cv: 23 J/(mol·K)[8] (suhu 21,1 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Tekanan uap
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sifat atom | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bilangan oksidasi | −1, 0[9] (mengoksidasi oksigen) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativitas | Skala Pauling: 3,98[10] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Energi ionisasi | ke-1: 1681 kJ/mol ke-2: 3374 kJ/mol ke-3: 6147 kJ/mol (artikel)[11] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jari-jari kovalen | 64 pm[12] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jari-jari van der Waals | 135 pm[13] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lain-lain | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kelimpahan alami | primordial | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Struktur kristal | kubus struktur ini mengacu pada fluorin padat, pada titik didih, 1 atm[14] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Konduktivitas termal | 0,02591 W/(m·K)[15] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Arah magnet | diamagnetik (−1,2×10−4)[16][17] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nomor CAS | 7782-41-4[10] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sejarah | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Penamaan | dari mineral fluorit, mineral itu sendiri dinamai dari Latin fluo (mengalir, dalam peleburan) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Penemuan | A. Ampère (1810) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isolasi pertama | H. Moissan[10] (26 Juni 1886) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Asal nama | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotop fluorin yang utama[18] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Fluorin atau fluor adalah sebuah unsur kimia dengan lambang F dan nomor atom 9. Ia merupakan halogen yang paling ringan dan muncul dalam kondisi standar sebagai gas diatomik kuning pucat yang sangat beracun. Sebagai unsur yang paling elektronegatif, ia sangat reaktif, karena bereaksi dengan semua unsur lain kecuali argon, neon, dan helium.
Di antara semua unsur, fluorin menempati urutan ke-24 dalam kelimpahan universal dan ke-13 dalam kelimpahan terestrial. Fluorit, sumber mineral utama fluorin yang memberi nama unsur tersebut, pertama kali dijelaskan pada tahun 1529; karena ia ditambahkan ke pada bijih logam untuk menurunkan titik leburnya agar dapat mempermudah peleburan, kata kerja Latin fluo yang berarti 'mengalir' memberi nama mineral tersebut. Diusulkan sebagai unsur pada tahun 1810, fluorin terbukti sulit dan berbahaya untuk dipisahkan dari senyawanya, dan beberapa peneliti awal meninggal atau menderita luka akibat percobaan mereka. Baru pada tahun 1886 ahli kimia Prancis Henri Moissan mengisolasi fluorin unsur menggunakan elektrolisis suhu rendah, sebuah proses yang masih digunakan untuk produksi modern. Produksi industri gas fluorin untuk pengayaan uranium, aplikasi terbesarnya, dimulai selama Proyek Manhattan dalam Perang Dunia II.
Karena biaya pemurnian fluorin murni yang mahal, sebagian besar aplikasi komersial menggunakan senyawa fluorin, dengan sekitar setengah dari fluorit yang ditambang digunakan dalam pembuatan baja. Sisa fluorit diubah menjadi hidrogen fluorida yang korosif dalam perjalanannya ke berbagai fluorida organik, atau menjadi kriolit, yang memainkan peranan kunci dalam pemurnian aluminium. Molekul yang mengandung ikatan karbon–fluorin seringkali memiliki stabilitas kimia dan termal yang sangat tinggi; kegunaan utama mereka adalah sebagai pendingin, isolasi listrik dan peralatan masak, dan PTFE (Teflon). Obat-obatan seperti atorvastatin dan fluoksetin mengandung ikatan C−F. Ion fluorida dari garam fluorida terlarut akan menghambat gigi berlubang, dan karenanya digunakan dalam pasta gigi dan fluoridasi air. Penjualan fluorokimia global mencapai lebih dari US$69 miliar per tahun.
Gas fluorokarbon umumnya merupakan gas rumah kaca dengan potensi pemanasan global 100 hingga 23.500 kali lipat lebih besar daripada karbon dioksida, dan SF6 memiliki potensi pemanasan global tertinggi dari semua zat yang diketahui. Senyawa organofluorin sering bertahan di lingkungan karena kekuatan ikatan karbon–fluorin. tidak memiliki peran metabolisme yang diketahui pada mamalia; beberapa tumbuhan dan spons laut menyintesis racun organofluorin (yang paling sering monofluoroasetat) yang membantu mencegah pemangsaan.[19]
Karakteristik
Konfigurasi elektron
Atom fluorin memiliki sembilan elektron, satu lebih sedikit dari neon, dan konfigurasi elektron 1s22s22p5: dua elektron di kulit dalam yang terisi dan tujuh di kulit terluar yang membutuhkan satu lagi untuk diisi. Elektron terluar tidak efektif pada pelindung inti, dan mengalami muatan inti efektif tinggi sebesar 9 − 2 = 7; hal ini mempengaruhi sifat fisik atom fluorin.[10]
Energi ionisasi pertama fluorin adalah yang tertinggi ketiga di antara semua unsur, di belakang helium dan neon,[20] yang memperumit pemindahan elektron dari atom fluorin netral. Ia juga memiliki afinitas elektron yang tinggi, kedua setelah klorin,[21] dan cenderung menangkap elektron menjadi isoelektronik dengan gas mulia neon;[10] ia memiliki elektronegativitas tertinggi dari setiap unsur.[22] Atom fluorin memiliki jari-jari kovalen yang kecil, sekitar 60 pikometer, mirip dengan tetangganya di periode yang sama, oksigen dan neon.[23][24][note 1]
Reaktivitas
 Nyala api yang terang selama reaksi fluorin Nyala api yang terang selama reaksi fluorin | |
 Fluorin bereaksi dengan sesium Fluorin bereaksi dengan sesium |

Energi ikatan difluorin jauh lebih rendah daripada Cl2 atau Br2 dan mirip dengan ikatan peroksida yang mudah dibelah; hal ini, bersama dengan elektronegativitas yang tinggi, menyebabkan disosiasi fluorin yang mudah, reaktivitas yang tinggi, dan ikatan yang kuat dengan atom nonfluorin.[25][26] Sebaliknya, ikatan dengan atom lain sangat kuat karena elektronegativitas fluorin yang tinggi. Zat yang tidak reaktif seperti bubuk baja, pecahan kaca, dan serat asbestos akan bereaksi cepat dengan gas fluorin dingin; kayu dan air secara spontan terbakar di bawah pancaran fluorin.[7][27]
Reaksi fluorin unsur dengan logam memerlukan kondisi yang bervariasi. Logam alkali akan menyebabkan ledakan dan logam alkali tanah menunjukkan aktivitas yang kuat dalam jumlah besar; untuk mencegah pasivasi dari pembentukan lapisan logam fluorida, sebagian besar logam lain seperti aluminium dan besi harus dibuat menjadi bubuk,[25] dan logam mulia membutuhkan gas fluorin murni pada suhu 300–450 °C (575–850 °F).[28] Beberapa nonlogam padat (sulfur, fosforus) bereaksi keras dalam fluorin cair.[29] Hidrogen sulfida[29] dan belerang dioksida[30] mudah bergabung dengan fluorin, dengan belerang dioksida terkadang meledak; asam sulfat menunjukkan aktivitas yang jauh lebih sedikit, membutuhkan suhu tinggi.[31]
Hidrogen, seperti beberapa logam alkali, bereaksi secara eksplosif dengan fluorin.[32] Karbon, seperti lampu hitam, bereaksi pada suhu kamar untuk menghasilkan fluorometana. Grafit akan bergabung dengan fluorin di atas 400 °C (750 °F) untuk menghasilkan karbon monofluorida yang nonstoikiometrik; suhu yang lebih tinggi menghasilkan fluorokarbon berbentuk gas, kadang-kadang dengan ledakan.[33] Karbon dioksida dan karbon monoksida bereaksi pada atau tepat di atas suhu kamar,[34] sedangkan parafin dan bahan kimia organik lainnya menghasilkan reaksi yang kuat:[35] bahkan haloalkana seperti karbon tetraklorida, biasanya tidak dapat terbakar, namun dapat meledak.[36] Meskipun nitrogen trifluorida itu stabil, nitrogen memerlukan pelepasan listrik pada suhu tinggi agar reaksi dengan fluorin dapat terjadi, karena ikatan rangkap tiga yang sangat kuat dalam unsur nitrogen;[37] amonia dapat bereaksi secara eksplosif.[38][39] Oksigen tidak dapat bergabung dengan fluorin dalam kondisi sekitar, tetapi dapat bereaksi menggunakan pelepasan listrik pada suhu dan tekanan rendah; produknya cenderung hancur menjadi unsur-unsur penyusunnya ketika dipanaskan.[40][41][42] Halogen yang lebih berat[43] mudah bereaksi dengan fluor seperti halnya gas mulia radon;[44] dari gas mulia lainnya, hanya xenon dan kripton yang bereaksi, dan hanya dalam kondisi khusus.[45]
Fase


Pada suhu kamar, fluorin merupakan sebuah gas molekul diatomik,[7] kuning pucat ketika murni (kadang-kadang digambarkan sebagai kuning-hijau).[46] Ia memiliki karakteristik bau menyengat dan menggigit seperti halogen yang terdeteksi pada 20 ppb.[47] Fluorin akan mengembun menjadi cairan kuning cerah pada suhu −188 °C (−306 °F), suhu transisi yang mirip dengan oksigen dan nitrogen.[48]
Fluorin memiliki dua bentuk padat, fluorin α dan β. Fluorin β mengkristal pada suhu −220 °C (−364 °F) dan terlihat transparan serta lembut, dengan struktur kubik tak teratur yang sama dari oksigen padat yang baru mengkristal,[48][note 2] tidak seperti sistem ortorombik dari halogen padat lainnya.[52][53] Pendinginan lebih lanjut hingga −228 °C (−378 °F) akan menginduksi transisi fase menjadi fluorin α yang buram dan keras, yang memiliki struktur monoklinik dengan lapisan molekul yang padat dan bersudut. Transisi dari fluorin β menjadi α lebih eksotermik daripada kondensasi fluor, dan dapat menimbulkan kekerasan.[52][53][note 3]
Isotop
Hanya ada satu isotop fluorin yang melimpah secara alami, yaitu isotop 19F yang stabil.[54] Ia memiliki rasio giromagnetik yang tinggi[note 4] dan kepekaan yang luar biasa terhadap medan magnet; karena ia juga merupakan satu-satunya isotop stabil, ia digunakan dalam pencitraan resonansi magnetik.[56] Delapan belas radioisotop dengan nomor massa 13 hingga 31 telah disintesis, di mana 18F merupakan yang paling stabil dengan waktu paruh 109,77 menit. Radioisotop lain memiliki waktu paruh kurang dari 70 detik; sebagian besar meluruh dalam waktu kurang dari setengah detik.[57] Isotop 17F dan 18F mengalami peluruhan β+ dan penangkapan elektron, isotop yang lebih ringan meluruh melalui emisi proton, dan isotop yang lebih berat daripada 19F mengalami peluruhan β− (yang terberat melalui emisi neutron tertunda).[57][58] Dua isomer metastabil fluorin telah diketahui, 18mF, dengan waktu paruh 162(7) nanodetik, dan 26mF, dengan waktu paruh 2,2(1) milidetik.[59]
Keterjadian
Alam semesta
| Nomor atom | Unsur | Jumlah relatif |
|---|---|---|
| 6 | Karbon | 4.800 |
| 7 | Nitrogen | 1.500 |
| 8 | Oksigen | 8.800 |
| 9 | Fluorin | 1 |
| 10 | Neon | 1.400 |
| 11 | Natrium | 24 |
| 12 | Magnesium | 430 |
Di antara unsur-unsur yang lebih ringan, nilai kelimpahan fluorin sebesar 400 ppb (bagian per miliar) – ke-24 di antara semua unsur di alam semesta – terlihat sangat rendah: unsur-unsur lain dari karbon hingga magnesium memiliki kelimpahan yang lebih besar dua puluh kali atau lebih daripada fluorin.[61] Hal ini dikarenakan proses nukleosintesis bintang melewati fluorin, dan atom fluor lainnya yang dibuat memiliki penampang nuklir yang tinggi, memungkinkan tumbukan dengan hidrogen atau helium untuk menghasilkan masing-masing oksigen atau neon.[61][62]
Di luar keberadaan sementara ini, tiga penjelasan telah diajukan mengenai keberadaan fluorin:[61][63]
- selama supernova tipe II, pemborbardiran atom neon oleh neutrino dapat mengubahnya menjadi fluorin;
- angin matahari dari bintang Wolf–Rayet dapat meniup fluorin dari atom hidrogen atau helium; atau
- fluor dikuatkan pada arus konveksi yang timbul dari fusi dalam bintang cabang raksasa asimtotik.
Bumi
Fluorin merupakan unsur ketiga belas yang paling umum di kerak Bumi pada 600–700 ppm (bagian per juta) berdasarkan massa.[64] Meskipun diyakini tidak terjadi secara alami, fluorin unsur telah terbukti hadir sebagai oklusi dalam antozonit, sebuah varian dari fluorit.[65] Kebanyakan fluorin muncul sebagai mineral yang mengandung fluorida. Fluorit, fluorapatit dan kriolit adalah yang paling signifikan secara industri.[64][66] Fluorit (CaF2), juga dikenal sebagai fluorspar, berlimpah di seluruh dunia, merupakan sumber utama fluorida, dan fluorin. Tiongkok dan Meksiko merupakan pemasok utama fluorit.[66][67][68][69][70] Fluorapatit (Ca5(PO4)3F), yang mengandung sebagian besar fluorida dunia, merupakan sumber fluorida yang tidak disengaja sebagai produk sampingan dari produksi pupuk.[66] Kriolit (Na3AlF6), digunakan dalam produksi aluminium, merupakan mineral yang paling kaya akan fluorin. Sumber alami kriolit yang ekonomis telah habis, dan sebagian besar sekarang disintesis secara komersial.[66]
-
 Fluorit: Massa globular pink dengan segi kristal
Fluorit: Massa globular pink dengan segi kristal -
 Fluorapatit: Kristal seperti prisma panjang, tanpa kilauan, pada sudut keluar dari batu seperti agregat
Fluorapatit: Kristal seperti prisma panjang, tanpa kilauan, pada sudut keluar dari batu seperti agregat -
 Kriolit: Garis besar berbentuk jajaran genjang dengan molekul diatomik yang tersusun dalam dua lapisan
Kriolit: Garis besar berbentuk jajaran genjang dengan molekul diatomik yang tersusun dalam dua lapisan
Mineral lain seperti topaz mengandung fluorin. Fluorida, tidak seperti halida lainnya, tidak larut dan tidak terjadi dalam konsentrasi yang menguntungkan secara komersial dalam air asin.[66] Jumlah renik dari organofluorin yang tidak diketahui asalnya telah terdeteksi pada letusan gunung berapi dan mata air panas bumi.[71] Keberadaan gas fluorin dalam kristal, diperkirakan oleh bau antozonit yang dihancurkan, masih diperdebatkan;[72][65] sebuah studi pada tahun 2012 melaporkan adanya 0,04% F2 dalam antozonit, menghubungkan inklusi ini dengan radiasi dari keberadaan sejumlah kecil uranium.[65]
Sejarah
Penemuan awal

Pada tahun 1529, Georgius Agricola menggambarkan fluorit sebagai aditif yang digunakan untuk menurunkan titik lebur logam selama peleburan.[73][74][note 5] Dia menulis kata Latin fluorēs (fluor, alir) untuk batuan fluorit. Nama tersebut kemudian berkembang menjadi fluorspar (masih umum digunakan) dan kemudian fluorit.[67][78][79] Komposisi fluorit kemudian ditentukan sebagai kalsium difluorida.[80]
Asam fluorida digunakan dalam etsa kaca dari tahun 1720 dan seterusnya.[note 6] Andreas Sigismund Marggraf pertama kali mengkarakterisasinya pada tahun 1764 ketika dia memanaskan fluorit dengan asam sulfat, dan larutan yang dihasilkan merusak wadah kacanya.[82][83] Kimiawan Swedia Carl Wilhelm Scheele mengulangi percobaan pada tahun 1771, dan menamakan produk asamnya sebagai fluss-spats-syran (asam fluorspar).[83][84] Pada tahun 1810, fisikawan Prancis André-Marie Ampère memperkirakan bahwa hidrogen dan unsur yang analog dengan klorin merupakan asam fluorida.[85] Dia juga mengusulkan dalam sebuah surat kepada Humphry Davy tertanggal 26 Agustus 1812 bahwa zat yang saat itu tidak diketahui ini dapat diberi nama fluorin dari asam fluorat dan akhiran -in dari halogen lainnya.[86][87] Kata ini, seringkali dengan modifikasi, digunakan di sebagian besar bahasa Eropa; namun, bahasa Yunani, Rusia, dan beberapa lainnya, mengikuti saran Ampère berikutnya, menggunakan nama ftor atau turunannya, dari bahasa Yunani φθόριος (phthorios, destruktif).[88] Nama Latin Baru fluorum memberikan unsur tersebut dengan lambangnya saat ini, F; Fl digunakan dalam beberapa makalah awal.[89][note 7]
Isolasi

Studi awal mengenai fluorin sangat berbahaya sehingga beberapa peneliti abad ke-19 dianggap sebagai "martir fluorin" setelah mengalami kemalangan dengan asam fluorida.[note 8] Isolasi fluorin unsur terhalang oleh korosif ekstrim dari fluorin unsur itu sendiri dan hidrogen fluorida, serta karena kekurangan elektrolit yang sederhana dan cocok.[80][90] Edmond Frémy mendalilkan bahwa elektrolisis hidrogen fluorida murni untuk menghasilkan fluorin dirasa layak dan dia merancang metode untuk menghasilkan sampel anhidrat dari kalium bifluorida yang diasamkan; sebaliknya, ia menemukan bahwa hidrogen fluorida (kering) yang dihasilkan tidak menghantarkan listrik.[80][90][91] Mantan siswa Frémy, Henri Moissan, dapat bertahan, dan setelah banyak coba-coba menemukan bahwa campuran kalium bifluorida dan hidrogen fluorida kering merupakan konduktor, yang memungkinkan terjadinya elektrolisis. Untuk mencegah korosi cepat dari platina dalam sel elektrokimianya, dia mendinginkan reaksi tersebut ke suhu yang sangat rendah dalam bak khusus dan memalsukan sel dari campuran platina dan iridium yang lebih tahan, dan menggunakan sumbat fluorit.[90][92] Pada tahun 1886, setelah usaha selama 74 tahun oleh banyak ahli kimia, Moissan dapat mengisolasi fluorin unsur.[91][93]
Pada tahun 1906, dua bulan sebelum kematiannya, Moissan menerima Penghargaan Nobel Kimia,[94] dengan kutipan berikut:[90]
[Dalam] pengakuan atas jasa besar yang diberikan olehnya dalam penyelidikan dan isolasi fluorin unsur ... Seluruh dunia telah mengagumi keterampilan eksperimental yang hebat yang dengannya Anda telah mempelajari binatang buas di antara unsur-unsur.[note 9]
Penggunaan selanjutnya

Divisi Frigidaire dari General Motors (GM) bereksperimen dengan refrigeran klorofluorokarbon pada akhir 1920-an, dan Kinetic Chemicals dibentuk sebagai perusahaan patungan antara GM dan DuPont pada tahun 1930 dengan harapan dapat memasarkan Freon-12 (CCl2F2) sebagai salah satu refrigeran tersebut. Ia menggantikan senyawa sebelumnya dan lebih beracun, meningkatkan permintaan lemari es dapur, dan menjadi menguntungkan; pada tahun 1949 DuPont telah membeli Kinetic dan memasarkan beberapa senyawa Freon lainnya.[83][95][96][97] Politetrafluoroetilena (Teflon) secara kebetulan ditemukan pada tahun 1938 oleh Roy J. Plunkett saat bekerja pada refrigeran di Kinetic, dan ketahanan kimia dan termalnya yang luar biasa menjadikan komersialisasinya yang dipercepat dan produksi massal pada tahun 1941.[83][95][96]
Produksi skala besar fluorin unsur dimulai selama Perang Dunia II. Jerman menggunakan elektrolisis suhu tinggi untuk membuat berton-ton pembakar yang direncanakan, klorin trifluorida[98] dan Proyek Manhattan menggunakan jumlah besar untuk memproduksi uranium heksafluorida untuk pengayaan uranium. Karena UF6 bersifat korosif seperti fluorin, pabrik difusi gas memerlukan bahan khusus: nikel untuk membran, fluoropolimer untuk segel, dan fluorokarbon cair sebagai pendingin dan pelumas. Industri nuklir yang berkembang ini kemudian mendorong pengembangan fluorokimia pascaperang.[99]
Senyawa
Fluorin memiliki kimia yang kaya, meliputi domain organik dan anorganik. Ia bergabung dengan logam, nonlogam, metaloid, dan sebagian besar gas mulia,[100] dan hampir secara eksklusif mengasumsikan bilangan oksidasi −1.[note 10] Afinitas elektron fluorin yang tinggi menghasilkan preferensi untuk ikatan ionik; ketika ia membentuk ikatan kovalen, mereka bersifat polar, dan hampir selalu tunggal.[103][104][note 11]
Logam
Logam alkali membentuk monofluorida ionik dan sangat larut; mereka memiliki susunan kubik natrium klorida dan klorida analog.[105][106] Difluorida alkali tanah memiliki ikatan ionik yang kuat tetapi tidak larut dalam air,[89] dengan pengecualian berilium difluorida, yang juga menunjukkan beberapa karakter kovalen dan memiliki struktur seperti kuarsa.[107] Unsur tanah jarang dan banyak logam lainnya sebagian besar membentuk trifluorida ionik.[108][109][110]
Ikatan kovalen pertama kali menonjol dalam tetrafluorida: ikatan kovalen zirkonium, hafnium[111][112] dan beberapa aktinida[113] bersifat ionik dengan titik lebur yang tinggi,[114][note 12] sedangkan ikatan kovalen titanium,[117] vanadium,[118] dan niobium bersifat polimerik,[119] melebur atau terurai tidak lebih dari 350 °C (660 °F).[120] Pentafluorida melanjutkan tren ini dengan polimer linier dan kompleks oligomernya.[121][122][123] Tiga belas heksafluorida logam telah diketahui,[note 13] semuanya oktahedral, dan sebagian besar merupakan padatan yang mudah menguap, tetapi MoF6 dan ReF6 merupakan cairan, dan WF6 merupakan gas.[124][125][126] Renium heptafluorida, satu-satunya heptafluorida logam yang telah dicirikan, merupakan padatan molekul dengan titik lebur yang rendah dengan geometri molekul bipiramidal pentagonal.[127] Fluorida logam dengan lebih banyak atom fluorin sangat reaktif.[128]
| Perkembangan struktural fluorida logam | ||
 |  |  |
| Natrium fluorida, ionik | Bismut pentafluorida, polimerik | Renium heptafluorida, molekular |
Hidrogen

Hidrogen dan fluorin bergabung untuk menghasilkan hidrogen fluorida, di mana molekul-molekul diskrit membentuk kelompok dengan ikatan hidrogen, yang lebih menyerupai air daripada hidrogen klorida.[129][130][131] Ia mendidih pada suhu yang jauh lebih tinggi daripada hidrogen halida yang lebih berat dan tidak seperti mereka yang dapat larut dengan air.[132] Hidrogen fluorida mudah terhidrasi saat melakukan kontak dengan air untuk membentuk hidrogen fluorida berair, juga dikenal sebagai asam fluorida. Tidak seperti asam hidrohalat lainnya, yang bersifat kuat, asam fluorida merupakan asam lemah pada konsentrasi rendah.[133][note 14] Namun, asam ini dapat menyerang kaca, sesuatu yang tidak dapat dilakukan oleh asam lainnya.[135]
Nonlogam reaktif lainnya

Fluorida biner dari metaloid dan nonlogam blok-p umumnya kovalen dan mudah menguap, dengan reaktivitas yang bervariasi. Periode 3 dan nonlogam yang lebih berat dapat membentuk fluorida hipervalen.[137]
Boron trifluorida merupakan planar dan memiliki oktet yang tidak lengkap. Ia berfungsi sebagai asam Lewis dan bergabung dengan basa Lewis seperti amonia untuk membentuk aduk.[138] Karbon tetrafluorida adalah tetrahedral dan lengai;[note 15] analog kelompoknya, silikon dan germanium tetrafluorida, juga tetrahedral[139] tetapi berperilaku sebagai asam Lewis.[140][141] Pniktogen membentuk trifluorida yang meningkatkan reaktivitas dan kebasaan dengan berat molekul yang lebih tinggi, meskipun nitrogen trifluorida menolak hidrolisis dan tidak basa.[142] Pentafluorida fosforus, arsen, dan antimon lebih reaktif daripada trifluorida mereka masing-masing, dengan antimon pentafluorida menjadi asam Lewis netral terkuat yang diketahui.[121][143][144]
Kalkogen memiliki beragam fluorida: difluorida yang tidak stabil telah dilaporkan untuk oksigen (satu-satunya senyawa yang diketahui dengan oksigen dalam bilangan oksidasi +2), belerang, dan selenium; tetrafluorida dan heksafluorida ada untuk belerang, selenium, dan telurium. Yang terakhir distabilkan oleh lebih banyak atom fluorin dan atom pusat yang lebih ringan, sehingga belerang heksafluorida sangat lengai.[145][146] Klorin, bromin, dan iodin masing-masing dapat membentuk mono-, tri-, dan pentafluorida, tetapi hanya iodin heptafluorida yang telah dicirikan di antara semua kemungkinan heptafluorida interhalogen.[147] Banyak dari mereka merupakan sumber kuat dari atom fluorin, dan aplikasi industri yang menggunakan klorin trifluorida memerlukan tindakan pencegahan yang serupa dengan yang menggunakan fluorin.[148][149]
Gas mulia

Gas mulia, yang memiliki kulit elektron lengkap, menentang reaksi dengan unsur lain sampai tahun 1962 ketika Neil Bartlett melaporkan penyintesisan xenon heksafluoroplatinat;[151] xenon difluorida, tetrafluorida, heksafluorida, dan beberapa oksifluorida telah diisolasi sejak saat itu.[152] Di antara gas mulia lainnya, kripton membentuk sebuah difluorida,[153] serta radon dan fluorin menghasilkan padatan yang diduga menjadi radon difluorida.[154][155] Fluorida biner dari gas mulia yang lebih ringan sangat tidak stabil: argon dan hidrogen fluorida bergabung dalam kondisi ekstrem untuk menghasilkan argon fluorohidrida.[45] Helium dan neon tidak memiliki fluorida berumur panjang,[156] dan tidak ada neon fluorida yang pernah teramati;[157] helium fluorohidrida telah terdeteksi selama milidetik pada tekanan tinggi dan suhu rendah.[156]
Senyawa organik


Ikatan karbon–fluorin merupakan ikatan kimia organik terkuat,[159] dan memberikan stabilitas pada organofluorin.[160] Ia hampir tidak ditemukan di alam, tetapi digunakan dalam senyawa buatan. Penelitian dalam bidang ini biasanya didorong oleh aplikasi komersial;[161] senyawa yang terlibat cukup beragam dan mencerminkan kompleksitas yang melekat dalam kimia organik.[95]
Molekul diskrit
Substitusi atom hidrogen dalam alkana oleh semakin banyak atom fluorin secara bertahap mengubah beberapa sifat: titik lebur dan titik didih diturunkan, densitas meningkat, kelarutan dalam hidrokarbon menurun dan stabilitas keseluruhan meningkat. Perfluorokarbon,[note 16] di mana semua atom hidrogen tersubstitusi, tidak larut dalam sebagian besar pelarut organik, bereaksi pada kondisi sekitar hanya dengan natrium dalam amonia cair.[162]
Istilah senyawa terperfluorinasi digunakan untuk apa yang seharusnya menjadi perfluorokarbon jika bukan karena adanya gugus fungsi,[163][note 17] sering kali asam karboksilat. Senyawa ini berbagi banyak sifat dengan perfluorokarbon seperti stabilitas dan hidrofobisitas,[165] sementara gugus fungsi menambah reaktivitas mereka, memungkinkan mereka untuk melekat pada permukaan atau bertindak sebagai surfaktan;[166] Fluorosurfaktan, khususnya, dapat menurunkan tegangan permukaan air lebih dari analog berbasis hidrokarbon mereka. Fluorotelomer, yang memiliki beberapa atom karbon yang tidak terperfluorinasi di dekat gugus fungsi, juga dianggap sebagai terperfluorinasi.[165]
Polimer
Polimer menunjukkan peningkatan stabilitas yang sama yang diberikan oleh substitusi fluorin (untuk hidrogen) dalam molekul diskrit; titik leburnya umumnya juga meningkat.[167] Politetrafluoroetilena (PTFE), fluoropolimer dan analog perfluoro polietilena paling sederhana dengan unit struktural –CF2–, menunjukkan perubahan ini seperti yang diperkirakan, tetapi titik leburnya yang sangat tinggi membuatnya sulit untuk dibentuk.[168] Berbagai turunan PTFE kurang tahan terhadap suhu tetapi lebih mudah dibentuk: etilena propilena terfluorinasi menggantikan beberapa atom fluorin dengan gugus trifluorometil, alkana perfluoroalkoksi melakukan hal yang sama dengan gugus trifluorometoksi,[168] dan Nafion mengandung rantai samping perfluoroeter yang ditutup dengan gugus asam sulfonat.[169][170] Fluoropolimer lain mempertahankan beberapa atom hidrogen; polivinilidena fluorida memiliki setengah atom fluorin dari PTFE dan polivinil fluorida memiliki seperempat, tetapi keduanya berperilaku seperti polimer terperfluorinasi.[171]
Produksi
Fluorin unsur dan hampir semua senyawa fluorin dihasilkan dari hidrogen fluorida atau larutan berairnya, asam fluorida. Hidrogen fluorida diproduksi dalam tanur melalui reaksi endotermik dari fluorit (CaF2) dengan asam sulfat:[172]
- CaF2 + H2SO4 → 2 HF(g) + CaSO4
Gas HF kemudian dapat diserap dalam air atau dicairkan.[173]
Sekitar 20% HF yang diproduksi adalah produk sampingan dari produksi pupuk, yang menghasilkan asam heksafluorosilikat (H2SiF6), yang dapat didegradasi untuk melepaskan HF secara termal dan hidrolisis:
- H2SiF6 → 2 HF + SiF4
- SiF4 + 2 H2O → 4 HF + SiO2

Metode Moissan digunakan untuk memproduksi sejumlah industri fluorin, melalui elektrolisis campuran kalium fluorida/hidrogen fluorida: ion hidrogen dan fluorida direduksi dan dioksidasi pada katode wadah baja dan anode blok karbon, di bawah 8–12 volt, untuk menghasilkan hidrogen dan gas fluorin masing-masing.[68][174] Temperatur dinaikkan, KF•2HF melebur pada suhu 70 °C (158 °F) and being electrolyzed at 70–130 °C (158–266 °F). KF, yang bertindak untuk memberikan konduktivitas listrik, sangat penting karena HF murni tidak dapat dielektrolisis karena hampir nonkonduktif.[83][175][176] Fluorin dapat disimpan dalam silinder baja yang memiliki interior pasif, pada suhu di bawah 200 °C (392 °F); jika tidak, nikel dapat digunakan.[83][177] Katup pengatur dan pipa terbuat dari nikel, dan pipa mungkin menggunakan Monel sebagai gantinya.[178] Pasivasi yang sering, bersama dengan pengecualian ketat terhadap air dan minyak, harus dilakukan. Di laboratorium, barang pecah belah dapat membawa gas fluorin di bawah tekanan rendah dan kondisi anhidrat;[178] beberapa sumber malah merekomendasikan sistem nikel-Monel-PTFE.[179]
Rute laboratorium
Saat mempersiapkan konferensi 1986 untuk merayakan seratus tahun pencapaian Moissan, Karl O. Christe beralasan bahwa pembuatan fluorin kimia harus layak karena beberapa anion fluorida logam tidak memiliki rekan netral yang stabil; pengasaman mereka berpotensi memicu oksidasi sebagai gantinya. Dia menemukan metode yang mengembangkan fluorin dengan hasil tinggi dan pada tekanan atmosfer:[180]
- 2 KMnO4 + 2 KF + 10 HF + 3 H2O2 → 2 K2MnF6 + 8 H2O + 3 O2↑
- 2 K2MnF6 + 4 SbF5 → 4 KSbF6 + 2 MnF3 + F2↑
Christe kemudian berkomentar bahwa reaktan "telah dikenal selama lebih dari 100 tahun dan bahkan Moissan bisa datang dengan skema ini."[181] Sampai akhir tahun 2008, beberapa referensi masih menegaskan bahwa fluorin terlalu reaktif untuk isolasi kimia apapun.[182]
Aplikasi industri
Penambangan fluorit, yang memasok sebagian besar fluorin global, mencapai puncaknya pada tahun 1989 ketika 5,6 juta ton metrik bijih diekstraksi. Pembatasan klorofluorokarbon menurunkan nilai ini menjadi 3,6 juta ton pada tahun 1994; sejak saat itu, produksinya meningkat. Sekitar 4,5 juta ton bijih dan pendapatan US$550 juta dihasilkan pada tahun 2003; laporan selanjutnya memperkirakan penjualan fluorokimia global tahun 2011 sebesar $15 miliar dan memperkirakan angka produksi 3,5 hingga 5,9 juta ton, dan pendapatan setidaknya $20 miliar.[83][183][184][185][186] Pengapungan memisahkan fluorit yang ditambang menjadi dua nilai metalurgi utama dengan proporsi yang sama: 60–85% metspar murni hampir semuanya digunakan dalam peleburan besi sedangkan 97%+ asam murni sebagian besar diubah menjadi hidrogen fluorida intermediat industri utama.[68][83][187]


Setidaknya 17.000 metrik ton fluorin diproduksi setiap tahun. Biayanya hanya $5–8 per kilogram sebagai uranium atau belerang heksafluorida, tetapi berkali-kali lebih mahal sebagai sebuah unsur karena penanganannya yang menantang. Sebagian besar proses yang menggunakan fluorin bebas dalam jumlah besar menggunakan pembangkitan in situ di bawah integrasi vertikal.[188]
Aplikasi terbesar dari gas fluorin, mengonsumsi hingga 7.000 metri ton per tahun, adalah dalam persiapan UF6 untuk siklus bahan bakar nuklir. Fluorin digunakan untuk mengfluorinasi uranium tetrafluorida, yang terbentuk dari uranium dioksida dan asam fluorida.[188] Fluorin bersifat monoisotopik, sehingga setiap perbedaan massa antara molekul UF6 disebabkan oleh adanya 235U atau 238U, yang memungkinkan pengayaan uranium melalui difusi gas atau pemusing gas.[7][68] Sekitar 6.000 metrik ton per year tahun digunakan untuk memproduksi SF6 dielektrik yang lengai untuk transformator tegangan tinggi dan pemutus sirkuit, menghilangkan kebutuhan akan bifenil terpoliklorinasi berbahaya yang terkait dengan perangkat berisi minyak.[189] Beberapa senyawa fluorin digunakan dalam elektronik: renium dan wolfram heksafluorida dalam pengendapan uap kimia, tetrafluorometana dalam etsa plasma,[190][191][192] dan nitrogen trifluorida dalam peralatan pembersih.[68] Fluorin juga digunakan dalam penyintesisan fluorida organik, tetapi reaktivitasnya sering kali memerlukan konversi terlebih dahulu menjadi ClF3, BrF3, atau IF5, yang lebih lembut, yang bersama-sama memungkinkan fluorinasi terkalibrasi. Obat-obatan terfluorinasi menggunakan belerang tetrafluorida sebagai gantinya.[68]
Fluorida anorganik
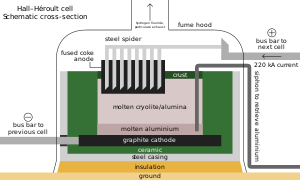
Seperti paduan besi lainnya, sekitar 3 kg (6,5 lb) metspar ditambahkan ke setiap metrik ton baja; ion fluorida menurunkan titik leleh dan kekentalannya.[68][193] Di samping perannya sebagai aditif dalam bahan seperti enamel dan lapisan batang las, sebagian besar acidspar direaksikan dengan asam sulfat untuk membentuk asam fluorida, yang digunakan dalam pengawetan baja, etsa kaca, dan perengkahan alkana.[68] Sepertiga HF digunakan untuk menyintesis kriolit dan aluminium trifluorida, keduanya mengalir dalam proses Hall–Héroult untuk ekstraksi aluminium; pengisian diperlukan oleh reaksi mereka dengan peralatan peleburan. Setiap metrik ton aluminium membutuhkan sekitar 23 kg (51 lb) fluks.[68][194] Fluorosilikat mengonsumsi porsi terbesar kedua, dengan natrium fluorosilikat digunakan dalam fluoridasi air dan pengolahan limbah cucian, dan sebagai intermediat dalam perjalanan mereka menjadi kriolit dan silikon tetrafluorida.[195] Fluorida anorganik penting lainnya termasuk kobalt, nikel, dan amonium.[68][106][196]
Fluorida organik
Organofluorida mengonsumsi lebih dari 20% fluorit yang ditambang dan lebih dari 40% asam fluorida, dengan gas refrigeran mendominasi dan fluoropolimer meningkatkan pangsa pasarnya.[68][197] Surfaktan adalah aplikasi kecil tetapi menghasilkan pendapatan tahunan lebih dari $1 miliar.[198] Karena bahaya dari reaksi hidrokarbon–fluorin langsung di atas −150 °C (−240 °F), produksi fluorokarbon industri tidak langsung, sebagian besar melalui reaksi pertukaran halogen seperti fluorinasi Swarts, di mana klorokarbon klorin diganti dengan fluorin oleh hidrogen fluorida di bawah katalis. Fluorinasi elektrokimia membuat hidrokarbon menjadi elektrolisis dalam hidrogen fluorida, dan proses Fowler memperlakukannya dengan pembawa fluorin padat seperti kobalt trifluorida.[95][199]
Gas refrigeran
Refrigeran terhalogenasi, disebut Freon dalam konteks informal,[note 18] are diidentifikasi dengan bilangan R yang menunjukkan jumlah fluorin, klorin, karbon, dan hidrogen yang ada.[68][200] Senyawa seperti klorofluorokarbon (CFC), R-11, R-12, dan R-114 pernah mendominasi organofluorin, dengan puncak produksinya pada 1980-an. Digunakan untuk sistem pendingin udara, propelan dan pelarut, produksinya di bawah sepersepuluh dari puncak ini pada awal 2000-an, setelah larangan internasional yang meluas.[68] Hidroklorofluorokarbon (HCFC) dan hidrofluorokarbon (HFC) dirancang sebagai pengganti; penyintesisan mereka mengonsumsi lebih dari 90% dari fluorin dalam industri organik. HCFC penting termasuk R-22, klorodifluorometana, dan R-141b. HFC yang paling utama adalah R-134a[68] dengan molekul tipe baru, HFO-1234yf, sebuah hidrofluoroolefin (HFO) yang menjadi terkenal karena potensi pemanasan globalnya hanya kurang dari 1% dari HFC-134a.[201]
Polimer

Sekitar 180.000 metrik ton fluoropolimer diproduksi pada tahun 2006 dan 2007, menghasilkan lebih dari $3,5 miliar pendapatan per tahun.[202] Penjualan di pasar global diperkirakan hanya di bawah $6 miliar pada tahun 2011 dan diprediksi akan tumbuh sebesar 6,5% per tahun hingga 2016.[203] Fluoropolimer hanya dapat dibentuk dengan mempolimerisasi radikal bebas.[167]
Politetrafluoroetilena (PTFE), kadang-kadang disebut dengan nama Teflon,[204] mewakili 60–80% massa produksi fluoropolimer dunia.[202] Aplikasi terbesarnya adalah dalam insulasi listrik karena PTFE merupakan dielektrik yang sangat baik. Ia juga digunakan dalam industri kimia di mana ketahanan korosi diperlukan, pada pipa pelapis, tubing, dan gasket. Penggunaan utama lainnya adalah pada kain serat kaca berlapis PFTE untuk atap stadion. Aplikasi konsumen utama adalah untuk peralatan masak anti lengket.[204] Film PTFE tersentak akan menjadi PTFE yang diperluas (expanded PTFE, ePTFE), sebuah membran berpori halus yang kadang-kadang disebut dengan nama merek Gore-Tex dan digunakan untuk pakaian hujan, pakaian pelindung, dan penyaring; serat ePTFE mungkin dapat dibuat menjadi seal dan penyaring debu.[204] Fluoropolimer lainnya, termasuk etilena propilena terfluorinasi, meniru sifat PTFE dan dapat menggantikannya; mereka lebih mudah dibentuk, tetapi juga lebih mahal dan memiliki stabilitas termal yang lebih rendah. Film dari dua fluoropolimer yang berbeda menggantikan kaca di sel surya.[204][205]
Ionomer terfluorinasi yang tahan kimia (tapi mahal) digunakan sebagai membran sel elektrokimia, di mana contoh pertama dan paling menonjol adalah Nafion. Dikembangkan pada 1960-an, ia awalnya digunakan sebagai bahan sel bahan bakar pada wahana antariksa dan kemudian menggantikan sel proses kloralkali berbasis raksa. Baru-baru ini, aplikasi sel bahan bakar telah muncul kembali dengan upaya memasang sel bahan bakar membran pertukaran proton ke dalam mobil.[206][207][208] Fluoroelastomer seperti Viton merupakan campuran fluoropolimer ikatan silang yang digunakan terutama dalam O-ring;[204] perfluorobutana (C4F10) digunakan sebagai bahan pemadam kebakaran.[209]
Surfaktan
Fluorosurfaktan adalah molekul organofluorin kecil yang digunakan untuk menolak air dan noda. Meskipun mahal (sebanding dengan obat-obatan dengan harga $200–2000 per kilogram), mereka menghasilkan lebih dari $1 miliar pendapatan tahunan pada tahun 2006; Scotchgard sendiri menghasilkan lebih dari $300 juta pada tahun 2000.[198][210][211] Fluorosurfaktan merupakan minoritas di pasar surfaktan secara keseluruhan, yang sebagian besar diambil oleh produk berbasis hidrokarbon yang jauh lebih murah. Aplikasi dalam cat terbebani oleh biaya peracikan; penggunaan ini hanya bernilai $100 juta pada tahun 2006.[198]
Bahan kimia pertanian
Sekitar 30% bahan kimia pertanian mengandung fluorin,[212] kebanyakan dari mereka merupakan herbisida dan fungisida dengan beberapa pengatur tanaman. Substitusi fluorin, biasanya dari atom tunggal atau paling banyak gugus trifluorometil, adalah modifikasi kuat dengan efek analog dengan obat-obatan berfluorinasi: peningkatan waktu tinggal biologis, menyilangi membran, dan mengubah pengenalan molekul.[213] Trifluralin merupakan contoh yang menonjol, dengan penggunaan skala besar di AS sebagai pembasmi rumput liar,[213][214] tetapi ia merupakan dicurigai bersifat karsinogen dan telah dilarang di banyak negara Eropa.[215] Natrium monofluoroasetat (1080) adalah racun mamalia di mana dua hidrogen asam asetat diganti dengan fluorin dan natrium; ia mengganggu metabolisme sel dengan mengganti asetat dalam siklus asam sitrat. Pertama kali disintesis pada akhir abad ke-19, ia dikenal sebagai insektisida pada awal abad ke-20, dan kemudian digunakan dalam penggunaannya saat ini. Selandia Baru, konsumen terbesar 1080, menggunakannya untuk melindungi kiwi dari posum ekor sikat umum Australia yang invasif.[216] Eropa dan AS telah melarang 1080.[217][218][note 19]
Aplikasi medis
Perawatan gigi

Studi populasi dari pertengahan abad ke-20 dan seterusnya menunjukkan fluorida topikal dapat mengurangi karies gigi. Hal ini pertama kali dikaitkan dengan konversi hidroksiapatit email gigi menjadi fluorapatit yang lebih tahan lama, tetapi penelitian pada gigi yang telah diberi fluorida membantah hipotesis ini, dan teori saat ini melibatkan fluorida yang membantu pertumbuhan email pada karies kecil.[219] Setelah penelitian terhadap anak-anak di daerah di mana fluorida secara alami hadir dalam air minum, fluoridasi pasokan air publik yang dikendalikan untuk melawan kerusakan gigi[220] dimulai pada tahun 1940-an dan sekarang diterapkan pada air yang memasok 6 persen dari populasi global, termasuk dua pertiga dari populasi Amerika.[221][222] Tinjauan literatur ilmiah pada tahun 2000 dan 2007 mengaitkan fluoridasi air dengan pengurangan kerusakan gigi yang signifikan pada anak-anak.[223] Meskipun dukungan tersebut dan bukti tidak adanya efek samping selain fluorosis gigi yang sebagian besar jinak,[224] oposisi masih ada pada alasan etika dan keamanan.[222][225] Manfaat fluoridasi telah berkurang, mungkin karena sumber fluorida lainnya, tetapi masih dapat diukur pada kelompok berpenghasilan rendah.[226] Natrium monofluorofosfat dan terkadang natrium atau timah(II) fluorida sering ditemukan dalam pasta gigi berfluorida, pertama kali diperkenalkan di AS pada tahun 1955 dan sekarang terdapat di mana-mana di negara maju, bersama dengan obat kumur, gel, busa, dan pernis berfluorida.[226][227]
Farmasi

Dua puluh persen dari obat-obatan modern mengandung fluorin.[228] Salah satunya, penurun kolesterol, atorvastatin (Lipitor), menghasilkan lebih banyak pendapatan daripada obat lain sampai menjadi obat generik pada tahun 2011.[229] Sebuah resep kombinasi asma Seretide, obat dengan pendapatan sepuluh besar pada pertengahan 2000-an, mengandung dua bahan aktif, salah satunya – flutikason – terfluorinasi.[230] Banyak obat yang difluorinasi untuk menunda inaktivasi dan memperpanjang periode dosis karena ikatan karbon–fluorin sangatlah stabil.[231] Fluorinasi juga meningkatkan lipofilitas karena ikatannya lebih hidrofobik daripada ikatan karbon–hidrogen, dan hal ini sering membantu dalam penetrasi membran sel dan bioavailabilitas.[230]
Trisiklik dan antidepresan pra 1980-an lainnya memiliki beberapa efek samping karena gangguan nonselektif mereka dengan neurotransmiter selain target serotonin; fluoksetin yang terfluorinasi dipilih dan menjadi salah satu yang pertama menghindari masalah ini. Banyak antidepresan saat ini menerima pengobatan yang sama, termasuk inhibitor penyerapan kembali serotonin selektif: sitalopram, isomernya esitalopram, dan fluvoksamin, serta paroksetin.[232][233] Kuinolon merupakan antibiotik spektrum luas buatan yang sering difluorinasi untuk meningkatkan efeknya. Mereka termasuk siprofloksasin dan levofloksasin.[234][235][236][237] Fluorin juga digunakan dalam steroid:[238] fludrokortison merupakan mineralokortikoid yang dapat meningkatkan tekanan darah, dan triamsinolon serta deksametason merupakan glukokortikoid yang kuat.[239] Mayoritas anestetik inhalasi sangat terfluorinasi; prototipe halotana jauh lebih lengai dan kuat daripada rekan sezamannya. Senyawa selanjutnya seperti eter sevofluran dan desfluran terfluorinasi terasa lebih baik daripada halotan dan hampir tidak larut dalam darah, memungkinkan waktu bangun yang lebih cepat.[240][241]
Pemindaian PET

Fluorin-18 sering ditemukan dalam pelacak radioaktif untuk tomografi emisi positron, karena waktu paruhnya yang hampir dua jam cukup lama untuk memungkinkan pengangkutannya dari fasilitas produksi menuju pusat pencitraan.[242] Pelacak yang paling umum adalah fluorodeoksiglukosa[242] yang, setelah melakukan injeksi pada intravena, diambil oleh jaringan yang membutuhkan glukosa seperti otak dan sebagian besar tumor ganas;[243] tomografi terkomputasi kemudian dapat digunakan untuk pencitraan yang lebih rinci.[244]
Pembawa oksigen
Fluorokarbon cair dapat menampung oksigen atau karbon dioksida dalam volume yang besar, lebih banyak daripada darah, dan telah menarik perhatian karena kemungkinan penggunaannya dalam darah buatan dan pernapasan cair.[245] Karena fluorokarbon biasanya tidak bercampur dengan air, mereka harus dicampur menjadi emulsi (tetesan kecil perfluorokarbon yang tersuspensi dalam air) untuk digunakan sebagai darah.[246][247] Salah satu produk tersebut, Oxycyte, telah melalui uji klinis awal.[248] Zat ini dapat membantu daya tahan atlet dan telah dilarang dalam olahraga; kematian seorang pengendara sepeda pada tahun 1998 mendorong penyelidikan atas penyalahgunaan mereka.[249][250] Aplikasi pernapasan cairan perfluorokarbon murni (yang menggunakan cairan perfluorokarbon murni, bukan emulsi air) termasuk membantu korban luka bakar dan bayi prematur dengan paru-paru yang tidak bekerja dengan baik. Pengisian paru-paru sebagian dan lengkap telah dipertimbangkan, meskipun hanya pengisian sebagian yang memiliki tes signifikan pada manusia.[251] Upaya Alliance Pharmaceuticals telah mencapai uji klinis tetapi ditinggalkan karena hasilnya tidak lebih baik dari terapi normal.[252]
Peran biologis

Fluorin tidaklah esensial tetapi dalam jumlah kecil diketahui bermanfaat untuk memperkuat enamel gigi (di mana pembentukan fluorapatit membuat enamel lebih tahan terhadap serangan, dari asam yang dihasilkan oleh fermentasi bakteri terhadap gula). Sejumlah kecil fluorin mungkin bermanfaat untuk kekuatan tulang, tetapi hal ini belum ditetapkan secara pasti.[253] Baik WHO maupun Institute of Medicine of the US National Academies menerbitkan angka kecukupan gizi (recommended daily allowance, RDA) dan asupan fluorin yang dapat ditoleransi, yang bervariasi menurut usia dan jenis kelamin.[254][255]
Organofluorin alami telah ditemukan pada mikroorganisme dan tumbuhan[71] tetapi tidak pada hewan.[256] Organofluorin alami yang paling umum adalah fluoroasetat, yang digunakan sebagai pertahanan terhadap herbivora oleh setidaknya 40 tanaman di Afrika, Australia, dan Brasil.[217] Contoh lainnya termasuk asam lemak, fluoroaseton, dan 2-fluorositrat terfluorinasi.[256] Sebuah enzim yang mengikat fluorin pada karbon – adenosil fluorida sintase – ditemukan pada bakteri pada tahun 2002.[257]
Toksisitas




Fluorin unsur sangat beracun bagi organisme hidup. Efeknya pada manusia dimulai pada konsentrasi yang lebih rendah dari 50 ppm hidrogen sianida[259] dan mirip dengan klorin:[260] iritasi signifikan pada mata dan sistem pernapasan serta kerusakan hati dan ginjal terjadi di atas 25 ppm, yang merupakan bahaya langsung bagi kehidupan dan nilai kesehatan untuk fluorin.[261] Mata dan hidung akan mengalami kerusakan parah pada 100 ppm,[261] dan menghirup 1.000 ppm fluorin akan menyebabkan kematian dalam hitungan menit,[262] dibandingkan dengan 270 ppm untuk hidrogen sianida.[263]
| Bahaya | |
|---|---|
| Piktogram GHS |     |
| H270, H330, H314, H318[264] | |
Asam fluorida

Asam fluorida adalah asam hidrohalat terlemah, memiliki pKa 3,2 pada suhu 25 °C.[266] Ia adalah cairan yang mudah menguap karena adanya ikatan hidrogen (sementara asam hidrohalat lainnya adalah gas). Ia mampu menyerang kaca, beton, logam, dan bahan-bahan organik.[267]
Asam fluorida merupakan racun kontak dengan bahaya yang lebih besar daripada banyak asam kuat seperti asam sulfat meskipun ia merupakan asam lemah: ia tetap netral dalam larutan air dan dapat menembus jaringan lebih cepat, baik melalui inhalasi, konsumsi atau kulit, dan setidaknya sembilan pekerja AS meninggal dari tahun 1984 hingga 1994 akibat kecelakaan tersebut. Ia bereaksi dengan kalsium dan magnesium dalam darah yang menyebabkan hipokalsemia dan kemungkinan kematian melalui aritmia jantung.[268] Pembentukan kalsium fluorida yang tidak larut memicu rasa sakit yang kuat[269] dan luka bakar yang lebih besar dari 160 cm2 (25 in2) dapat menyebabkan toksisitas sistemik yang serius.[270]
Paparan mungkin tidak terlihat selama delapan jam untuk 50% HF, meningkat menjadi 24 jam untuk konsentrasi yang lebih rendah, dan luka bakar pada awalnya mungkin tidak menimbulkan rasa sakit karena hidrogen fluorida mempengaruhi fungsi saraf. Jika kulit telah terkena HF, kerusakan dapat dikurangi dengan membilasnya di bawah pancaran air selama 10-15 menit dan melepaskan pakaian yang terkontaminasi.[271] Kalsium glukonat sering diterapkan berikutnya, menyediakan ion kalsium untuk berikat dengan fluorida; luka bakar kulit dapat diobati dengan gel kalsium glukonat 2,5% atau larutan pembilas khusus.[272][273][274] Penyerapan asam fluorida membutuhkan perawatan medis lebih lanjut; kalsium glukonat dapat disuntikkan atau diberikan secara intravena. Menggunakan kalsium klorida – reagen laboratorium yang umum – sebagai pengganti kalsium glukonat dikontraindikasikan, dan dapat menyebabkan komplikasi parah. Eksisi atau amputasi bagian yang terkena mungkin diperlukan.[270][275]
Ion fluorida
Fluorida yang larut cukup beracun: 5–10 g natrium fluorida, atau 32–64 mg ion fluorida per kilogram massa tubuh, merupakan dosis letal untuk orang dewasa.[276] Seperlima dari dosis letal dapat menyebabkan efek kesehatan yang merugikan,[277] dan konsumsi berlebihan kronis dapat menyebabkan fluorosis tulang, yang mempengaruhi jutaan orang di Asia dan Afrika.[277][278] Fluorida yang tertelan membentuk asam fluorida di lambung yang mudah diserap oleh usus, di mana ia melintasi membran sel, mengikat kalsium dan mengganggu berbagai enzim, sebelum diekskresikan melalui urin. Batas paparan ditentukan oleh tes urin dari kemampuan tubuh untuk membersihkan ion fluorida.[277][279]
Secara historis, sebagian besar kasus keracunan fluorida disebabkan oleh konsumsi insektisida yang mengandung fluorida anorganik secara tidak sengaja.[280] Sebagian besar panggilan terkini ke pusat kendali racun untuk kemungkinan keracunan fluorida berasal dari konsumsi pasta gigi yang mengandung fluorida.[277] Peralatan fluoridasi air yang tidak berfungsi adalah salah satu penyebab lainnya: satu insiden di Alaska mempengaruhi hampir 300 orang dan membunuh satu orang.[281] Bahaya dari pasta gigi diperparah untuk anak kecil, dan Pusat Pengendalian dan Pencegahan Penyakit merekomendasikan pengawasan terhadap anak-anak di bawah enam tahun untuk menyikat gigi agar mereka tidak menelan pasta gigi.[282] Satu studi regional meneliti satu tahun laporan keracunan fluorida praremaja dengan total 87 kasus, termasuk satu kematian akibat menelan insektisida. Sebagian besar tidak menunjukkan gejala, tetapi sekitar 30% mengalami sakit perut.[280] Sebuah penelitian yang lebih besar di seluruh AS memiliki temuan serupa: 80% kasus melibatkan anak-anak di bawah enam tahun, dan hanya ada beberapa kasus serius.[283]
Masalah lingkungan
Atmosfer

Protokol Montreal, yang ditandatangani pada tahun 1987, menetapkan peraturan ketat mengenai klorofluorokarbon (CFC) dan bromofluorokarbon karena potensi pengrusakan ozon (ozone damaging potential, ODP) mereka. Stabilitas tinggi yang sesuai dengan aplikasi aslinya juga berarti bahwa mereka tidak membusuk sampai mereka mencapai ketinggian yang lebih tinggi, di mana atom klorin dan bromin yang dibebaskan menyerang molekul ozon.[285] Bahkan dengan larangan, dan indikasi awal kemanjurannya, prediksi memperingatkan bahwa beberapa generasi akan berlalu sebelum pemulihan penuh.[286][287] Dengan sepersepuluh ODP CFC, hidroklorofluorokarbon (HCFCs) adalah pengganti saat ini,[288] dan dijadwalkan untuk diganti pada tahun 2030–2040 oleh hidrofluorokarbon (HFC) tanpa klorin dan nol ODP.[289] Pada tahun 2007 tanggal ini dimajukan menjadi tahun 2020 untuk negara maju;[290] Badan Perlindungan Lingkungan AStelah melarang satu produksi HCFC dan membatasi produksi dua lainnya pada tahun 2003.[289] Gas fluorokarbon umumnya merupakan gas rumah kaca dengan potensi pemanasan global (global-warming potential, GWP) sekitar 100 hingga 10.000; belerang heksafluorida memiliki nilai sekitar 20.000.[291] Sebuah outlier adalah HFO-1234yf yang merupakan jenis refrigeran baru yang disebut Hidrofluoroolefin (HFO) dan telah menarik permintaan global karena GWP-nya kurang dari 1 dibandingkan dengan 1.430 untuk standar refrigeran saat ini, HFC-134a.[201]
Biopersistensi

Organofluorin menunjukkan biopersistensi karena kekuatan dari ikatan karbon–fluorin. Asam perfluoroalkil (perfluoroalkyl acids, PFAA), yang sedikit larut dalam air karena gugus fungsional asamnya, tercatat sebagai polutan organik persisten;[293] asam perfluorooktansulfonat (perfluorooctanesulfonic acid, PFOS) dan asam perfluorooktanoat (perfluorooctanoic acid, PFOA) merupakan yang paling sering diteliti.[294][295][296] PFAA telah ditemukan dalam jumlah kecil di seluruh dunia dari beruang kutub hingga manusia, dengan PFOS dan PFOA diketahui berada dalam ASI dan darah bayi yang baru lahir. Sebuah tinjauan 2013 menunjukkan sedikit korelasi antara air tanah dan tingkat PFAA tanah dan aktivitas manusia; tidak ada pola yang jelas dari satu bahan kimia yang mendominasi, dan jumlah PFOS yang lebih tinggi berkorelasi dengan jumlah PFOA yang lebih tinggi.[294][295][297] Di dalam tubuh, PFAA mengikat protein seperti albumin serum; mereka cenderung berkonsentrasi dalam manusia di hati dan darah sebelum diekskresikan melalui ginjal. Waktu tinggal mereka di dalam tubuh sangat bervariasi menurut spesies, dengan waktu paruh dalam beberapa hari pada hewan pengerat, dan dalam beberapa tahun pada manusia.[294][295][298] PFOS dan PFOA dosis tinggi akan menyebabkan kanker dan kematian pada hewan pengerat yang baru lahir tetapi penelitian pada manusia belum menunjukkan efek pada tingkat paparan saat ini.[294][295][298]
Lihat pula
- Elektrode selektif fluorida, yang mengukur konsentrasi fluorida
- Fluorinasi elektrofilik
- Fluorinasi radikal
- Kimia fluorin, proses yang digunakan untuk memisahkan reagen dari pelarut organik
- Laser fluorida argon
- Laser fluorida kripton
- Penanggalan penyerapan fluorin
Catatan
- ^ Sumber ini tidak setuju pada jari-jari atom oksigen, fluorin, dan neon. Perbandingan yang tepat dengan demikian tidak dimungkinkan.
- ^ Fluorin α memiliki pola molekul yang teratur dan merupakan padatan kristal, tetapi molekulnya tidak memiliki orientasi tertentu. Molekul fluorin β memiliki lokasi yang tetap dan ketidakpastian rotasi yang kecil. Untuk detail lebih lanjut mengenai fluorin α, lihat struktur 1970 oleh Pauling.[49] Untuk detail lebih lanjut mengenai konsep ketidakteraturan dalam kristal, lihat ulasan umum yang dirujuk.[50][51]
- ^ Terdengar bunyi klik yang keras. Sampel dapat pecah dan jendela sampel meledak.
- ^ Rasio momentum sudut dengan momen magnetik disebut rasio giromagnetik. "Inti tertentu untuk banyak tujuan dapat dianggap berputar pada sumbu seperti Bumi atau seperti puncak. Secara umum, putaran memberi mereka momentum sudut dan momen magnet; yang pertama karena massanya, yang kedua karena semua atau bagian dari muatan listrik mereka mungkin berputar dengan massa."[55]
- ^ Basilius Valentinus diduga menggambarkan fluorit pada akhir abad ke-15, tetapi karena tulisannya ditemukan 200 tahun kemudian, kebenaran daripada karya ini diragukan.[75][76][77]
- ^ Atau mungkin sejak tahun 1670 dan seterusnya; Partington[81] dan Weeks[80] memberikan penjelasan yang berbeda.
- ^ Fl, sejak 2012, digunakan untuk flerovium.
- ^ Davy, Gay-Lussac, Thénard, dan ahli kimia Irlandia Thomas dan George Knox terluka. Ahli kimia Belgia Paulin Louyet dan ahli kimia Prancis Jérôme Nicklès meninggal. Moissan juga mengalami keracunan hidrogen fluorida yang serius.[80][90]
- ^ Yang juga dihormati adalah penemuan tanur busur listrik.
- ^ Fluorin dalam F2 didefinisikan memiliki bilangan oksidasi 0. Spesies F−2 dan F−3 yang tidak stabil, yang terurai pada sekitar 40 K, memiliki bilangan oksidasi menengah;[101] F+4 dan beberapa spesies terkait diprediksi stabil.[102]
- ^ Boron dan nitrogen monofluorida metastabil memiliki ikatan fluorin tingkat tinggi, dan beberapa kompleks logam menggunakannya sebagai ligan penghubung. Ikatan hidrogen adalah kemungkinan lain.
- ^ ZrF4 melebur pada suhu 932 °C (1710 °F),[115] HfF4 menyublim pada suhu 968 °C (1774 °F),[112] dan UF4 melebur pada suhu 1036 °C (1897 °F).[116]
- ^ Ketiga belas logam tersebut adalah molibdenum, teknesium, rutenium, rodium, wolfram, renium, osmium, iridium, platina, polonium, uranium, neptunium, dan plutonium.
- ^ Lihat juga penjelasan dari Clark.[134]
- ^ Karbon tetrafluorida secara formal organik, tetapi dimasukkan di sini daripada di bagian kimia organofluorin – di mana senyawa karbon-fluorin yang lebih kompleks dibahas – untuk perbandingan dengan SiF4 dan GeF4.
- ^ Perfluorokarbon dan fluorokarbon merupakan sinonim IUPAC untuk molekul yang hanya mengandung karbon dan fluorin, tetapi dalam konteks sehari-hari dan komersial, istilah fluorokarbon dapat merujuk pada molekul yang mengandung karbon dan fluorin, mungkin dengan unsur lainnya.
- ^ Terminologi ini tidak tepat, dan zat terperfluorinasi juga digunakan.[164]
- ^ Merek dagang DuPont ini terkadang disalahgunakan lebih lanjut untuk CFC, HFC, atau HCFC.
- ^ Kalung domba dan sapi Amerika dapat menggunakan 1080 untuk melawan predator seperti koyote.
Sumber
Rujukan
- ^ (Indonesia) "Fluorin". KBBI Daring. Diakses tanggal 17 Juli 2022.
- ^ a b Aigueperse et al. 2005, "Fluorine", hlm. 1.
- ^ a b c d Haynes 2011, hlm. 4.121.
- ^ Aigueperse et al. 2005, "Fluorine", hlm. 2.
- ^ Jarry, Roger L.; Miller, Henry C. (1956). "The Density of Liquid Fluorine between 67 and 103°K". Journal of the American Chemical Society. 78: 1552. doi:10.1021/ja01589a012. Parameter
|access-date=membutuhkan|url=(bantuan) - ^ Dean 1999, hlm. 942.
- ^ a b c d Jaccaud et al. 2000, hlm. 382.
- ^ a b Compressed Gas Association 1999, hlm. 365.
- ^ Himmel, D.; Riedel, S. (2007). "After 20 Years, Theoretical Evidence That 'AuF7' Is Actually AuF5·F2". Inorganic Chemistry. 46 (13). 5338–5342. doi:10.1021/ic700431s.
- ^ a b c d e Jaccaud et al. 2000, hlm. 381.
- ^ Dean 1999, hlm. 4.6.
- ^ Dean 1999, hlm. 4.35.
- ^ Matsui 2006, hlm. 257.
- ^ Young, David A. (1975). Phase Diagrams of the Elements (Laporan). Springer. hlm. 10. Parameter
|access-date=membutuhkan|url=(bantuan) - ^ Yaws & Braker 2001, hlm. 385.
- ^ Mackay, Mackay & Henderson 2002, hlm. 72.
- ^ Cheng et al. 1999.
- ^ Chisté & Bé 2011.
- ^ Lee et al. 2014.
- ^ Dean 1999, hlm. 564.
- ^ Lide 2004, hlm. 10.137–10.138.
- ^ Moore, Stanitski & Jurs 2010, hlm. 156.
- ^ Cordero et al. 2008.
- ^ Pyykkö & Atsumi 2009.
- ^ a b Greenwood & Earnshaw 1998, hlm. 804.
- ^ Macomber 1996, hlm. 230
- ^ Nelson 1947.
- ^ Lidin, Molochko & Andreeva 2000, hlm. 442–455.
- ^ a b Wiberg, Wiberg & Holleman 2001, hlm. 404.
- ^ Patnaik 2007, hlm. 472.
- ^ Aigueperse et al. 2000, hlm. 400.
- ^ Greenwood & Earnshaw 1998, hlm. 76, 804.
- ^ Kuriakose & Margrave 1965.
- ^ Hasegawa et al. 2007.
- ^ Lagow 1970, hlm. 64–78.
- ^ Lidin, Molochko & Andreeva 2000, hlm. 252.
- ^ Tanner Industries 2011.
- ^ Morrow, Perry & Cohen 1959.
- ^ Emeléus & Sharpe 1974, hlm. 111.
- ^ Wiberg, Wiberg & Holleman 2001, hlm. 457.
- ^ Brantley 1949, hlm. 26.
- ^ Jaccaud et al. 2000, hlm. 383.
- ^ Pitzer 1975.
- ^ a b Khriachtchev et al. 2000.
- ^ Burdon, Emson & Edwards 1987.
- ^ Lide 2004, hlm. 4.12.
- ^ a b Dean 1999, hlm. 523.
- ^ Pauling, Keaveny & Robinson 1970.
- ^ Bürgi 2000.
- ^ Müller 2009.
- ^ a b Young 1975, hlm. 10.
- ^ a b Barrett, Meyer & Wasserman 1967.
- ^ National Nuclear Data Center & NuDat 2.1, Fluorine-19.
- ^ Vigoureux 1961.
- ^ Meusinger, Chippendale & Fairhurst 2012, hlm. 752, 754.
- ^ a b National Nuclear Data Center & NuDat 2.1.
- ^ NUBASE 2016, hlm. 030001-23–030001-27.
- ^ NUBASE 2016, hlm. 030001–24.
- ^ Cameron 1973.
- ^ a b c Croswell 2003.
- ^ Clayton 2003, hlm. 101–104.
- ^ Renda et al. 2004.
- ^ a b Jaccaud et al. 2000, hlm. 384.
- ^ a b c Schmedt, Mangstl & Kraus 2012.
- ^ a b c d e Greenwood & Earnshaw 1998, hlm. 795.
- ^ a b Norwood & Fohs 1907, hlm. 52.
- ^ a b c d e f g h i j k l m n Villalba, Ayres & Schroder 2008.
- ^ Kelly & Miller 2005.
- ^ Lusty et al. 2008.
- ^ a b Gribble 2002.
- ^ Richter, Hahn & Fuchs 2001, hlm. 3.
- ^ Greenwood & Earnshaw 1998, hlm. 790.
- ^ Senning 2007, hlm. 149.
- ^ Stillman 1912.
- ^ Principe 2012, hlm. 140, 145.
- ^ Agricola, Hoover & Hoover 1912, catatan kaki dan komentar, hlm. xxx, 38, 409, 430, 461, 608.
- ^ Greenwood & Earnshaw 1998, hlm. 109.
- ^ Agricola, Hoover & Hoover 1912, kata pengantar, hlm. 380–381.
- ^ a b c d e Weeks 1932.
- ^ Partington 1923.
- ^ Marggraf 1770.
- ^ a b c d e f g h Kirsch 2004, hlm. 3–10.
- ^ Scheele 1771.
- ^ Ampère 1816.
- ^ Tressaud, Alain (6 October 2018). Fluorine: A Paradoxical Element. ISBN 9780128129913. Diarsipkan dari versi asli tanggal 2023-07-22. Diakses tanggal 2022-08-04.
- ^ Davy 1813, hlm. 278.
- ^ Banks 1986, hlm. 11.
- ^ a b Storer 1864, hlm. 278–280.
- ^ a b c d e Toon 2011.
- ^ a b Asimov 1966, hlm. 162.
- ^ Greenwood & Earnshaw 1998, hlm. 789–791.
- ^ Moissan 1886.
- ^ Viel & Goldwhite 1993, hlm. 35.
- ^ a b c d Okazoe 2009.
- ^ a b Hounshell & Smith 1988, hlm. 156–157.
- ^ DuPont 2013a.
- ^ Meyer 1977, hlm. 111.
- ^ Kirsch 2004, hlm. 60–66.
- ^ Riedel & Kaupp 2009.
- ^ Wiberg, Wiberg & Holleman 2001, hlm. 422.
- ^ Schlöder & Riedel 2012.
- ^ Harbison 2002.
- ^ Edwards 1994, hlm. 515.
- ^ Katakuse et al. 1999, hlm. 267.
- ^ a b Aigueperse et al. 2000, hlm. 420–422.
- ^ Walsh 2009, hlm. 99–102, 118–119.
- ^ Emeléus & Sharpe 1983, hlm. 89–97.
- ^ Babel & Tressaud 1985, hlm. 91–96.
- ^ Einstein et al. 1967.
- ^ Brown et al. 2005, hlm. 144.
- ^ a b Perry 2011, hlm. 193.
- ^ Kern et al. 1994.
- ^ Lide 2004, hlm. 4.60, 4.76, 4.92, 4.96.
- ^ Lide 2004, hlm. 4.96.
- ^ Lide 2004, hlm. 4.92.
- ^ Greenwood & Earnshaw 1998, hlm. 964.
- ^ Becker & Müller 1990.
- ^ Greenwood & Earnshaw 1998, hlm. 990.
- ^ Lide 2004, hlm. 4.72, 4.91, 4.93.
- ^ a b Greenwood & Earnshaw 1998, hlm. 561–563.
- ^ Emeléus & Sharpe 1983, hlm. 256–277.
- ^ Mackay, Mackay & Henderson 2002, hlm. 355–356.
- ^ Greenwood & Earnshaw 1998, (berbagai halaman, dengan logam di masing-masing bab).
- ^ Lide 2004, hlm. 4.71, 4.78, 4.92.
- ^ Drews et al. 2006.
- ^ Greenwood & Earnshaw 1998, hlm. 819.
- ^ Bartlett 1962.
- ^ Pauling 1960, hlm. 454–464.
- ^ Atkins & Jones 2007, hlm. 184–185.
- ^ Emsley 1981.
- ^ Greenwood & Earnshaw 1998, hlm. 812–816.
- ^ Wiberg, Wiberg & Holleman 2001, hlm. 425.
- ^ Clark 2002.
- ^ Chambers & Holliday 1975, hlm. 328–329.
- ^ Air Products and Chemicals 2004, hlm. 1.
- ^ Noury, Silvi & Gillespie 2002.
- ^ Chang & Goldsby 2013, hlm. 706.
- ^ Ellis 2001, hlm. 69.
- ^ Aigueperse et al. 2000, hlm. 423.
- ^ Wiberg, Wiberg & Holleman 2001, hlm. 897.
- ^ Raghavan 1998, hlm. 164–165.
- ^ Godfrey et al. 1998, hlm. 98.
- ^ Aigueperse et al. 2000, hlm. 432.
- ^ Murthy, Mehdi Ali & Ashok 1995, hlm. 180–182, 206–208.
- ^ Greenwood & Earnshaw 1998, hlm. 638–640, 683–689, 767–778.
- ^ Wiberg, Wiberg & Holleman 2001, hlm. 435–436.
- ^ Greenwood & Earnshaw 1998, hlm. 828–830.
- ^ Patnaik 2007, hlm. 478–479.
- ^ Moeller, Bailar & Kleinberg 1980, hlm. 236.
- ^ Wiberg, Wiberg & Holleman 2001, hlm. 392–393.
- ^ Wiberg, Wiberg & Holleman 2001, hlm. 395–397, 400.
- ^ Lewars 2008, hlm. 68.
- ^ Pitzer 1993, hlm. 111.
- ^ Lewars 2008, hlm. 67.
- ^ a b Bihary, Chaban & Gerber 2002.
- ^ Lewars 2008, hlm. 71.
- ^ Hoogers 2002, hlm. 4–12.
- ^ O'Hagan 2008.
- ^ Siegemund et al. 2005, hlm. 444.
- ^ Sandford 2000, hlm. 455.
- ^ Siegemund et al. 2005, hlm. 451–452.
- ^ Barbee, McCormack & Vartanian 2000, hlm. 116.
- ^ Posner et al. 2013, hlm. 187–190.
- ^ a b Posner 2011, hlm. 27.
- ^ Salager 2002, hlm. 45.
- ^ a b Carlson & Schmiegel 2000, hlm. 3.
- ^ a b Carlson & Schmiegel 2000, hlm. 3–4.
- ^ Rhoades 2008, hlm. 2.
- ^ Okada et al. 1998.
- ^ Carlson & Schmiegel 2000, hlm. 4.
- ^ Aigueperse et al. 2000.
- ^ Norris Shreve; Joseph Brink, Jr. (1977). Chemical Process Industries (edisi ke-4). hlm. 321. ISBN 0070571457.
- ^ Jaccaud et al. 2000, hlm. 386.
- ^ Jaccaud et al. 2000, hlm. 384–285.
- ^ Greenwood & Earnshaw 1998, hlm. 796–797.
- ^ Jaccaud et al. 2000, hlm. 384–385.
- ^ a b Jaccaud et al. 2000, hlm. 390–391.
- ^ Shriver & Atkins 2010, hlm. 427.
- ^ Christe 1986.
- ^ Christe Research Group n.d.
- ^ Carey 2008, hlm. 173.
- ^ Miller 2003b.
- ^ PRWeb 2012.
- ^ Bombourg 2012.
- ^ TMR 2013.
- ^ Fulton & Miller 2006, hlm. 471.
- ^ a b Jaccaud et al. 2000, hlm. 392.
- ^ Aigueperse et al. 2000, hlm. 430.
- ^ Jaccaud et al. 2000, hlm. 391–392.
- ^ El-Kareh 1994, hlm. 317.
- ^ Arana et al. 2007.
- ^ Miller 2003a.
- ^ Energetics, Inc. 1997, hlm. 41, 50.
- ^ Aigueperse et al. 2000, hlm. 428.
- ^ Willey 2007, hlm. 113.
- ^ PRWeb 2010.
- ^ a b c Renner 2006.
- ^ Green et al. 1994, hlm. 91–93.
- ^ DuPont 2013b.
- ^ a b Walter 2013.
- ^ a b Buznik 2009.
- ^ PRWeb 2013.
- ^ a b c d e Martin 2007, hlm. 187–194.
- ^ DeBergalis 2004.
- ^ Grot 2011, hlm. 1–10.
- ^ Ramkumar 2012, hlm. 567.
- ^ Burney 1999, hlm. 111.
- ^ Slye 2012, hlm. 10.
- ^ Kissa 2001, hlm. 516–551.
- ^ Ullmann 2008, hlm. 538, 543–547.
- ^ ICIS 2006.
- ^ a b Theodoridis 2006.
- ^ EPA 1996.
- ^ DG Environment 2007.
- ^ Beasley 2002.
- ^ a b Proudfoot, Bradberry & Vale 2006.
- ^ Eisler 1995.
- ^ Pizzo et al. 2007.
- ^ CDC 2001.
- ^ Ripa 1993.
- ^ a b Cheng, Chalmers & Sheldon 2007.
- ^ NHMRC 2007; lihat Yeung 2008 untuk ringkasan.
- ^ Marya 2011, hlm. 343.
- ^ Armfield 2007.
- ^ a b Baelum, Sheiham & Burt 2008, hlm. 518.
- ^ Cracher 2012, hlm. 12.
- ^ Emsley 2011, hlm. 178.
- ^ Johnson 2011.
- ^ a b Swinson 2005.
- ^ Hagmann 2008.
- ^ Mitchell 2004, hlm. 37–39.
- ^ Preskorn 1996, chap. 2.
- ^ Werner et al. 2011.
- ^ Brody 2012.
- ^ Nelson et al. 2007.
- ^ King, Malone & Lilley 2000.
- ^ Parente 2001, hlm. 40.
- ^ Raj & Erdine 2012, hlm. 58.
- ^ Filler & Saha 2009.
- ^ Bégué & Bonnet-Delpon 2008, hlm. 335–336.
- ^ a b Schmitz et al. 2000.
- ^ Bustamante & Pedersen 1977.
- ^ Alavi & Huang 2007, hlm. 41.
- ^ Gabriel et al. 1996.
- ^ Sarkar 2008.
- ^ Schimmeyer 2002.
- ^ Davis 2006.
- ^ Gains 1998.
- ^ Taber 1999.
- ^ Shaffer, Wolfson & Clark Jr 1992, hlm. 102.
- ^ Kacmarek et al. 2006.
- ^ Nielsen 2009.
- ^ Olivares & Uauy 2004.
- ^ Food and Nutrition Board.
- ^ a b Murphy, Schaffrath & O'Hagan 2003
- ^ O'Hagan et al. 2002.
- ^ National Oceanic and Atmospheric Administration.
- ^ The National Institute for Occupational Safety and Health 1994a.
- ^ The National Institute for Occupational Safety and Health 1994b.
- ^ a b Keplinger & Suissa 1968.
- ^ Emsley 2011, hlm. 179.
- ^ Biller 2007, hlm. 939.
- ^ "Fluorine. Safety data sheet" (PDF). Airgas. Diarsipkan dari versi asli (PDF) tanggal 19 April 2015.
- ^ Eaton 1997.
- ^ "Inorganic Chemistry" by Gary L. Miessler and Donald A. Tarr, edisi ke-4, Pearson
- ^ "Inorganic Chemistry" by Shriver, Weller, Overton, Rourke and Armstrong, edisi ke-6, Freeman
- ^ Blodgett, Suruda & Crouch 2001.
- ^ Hoffman et al. 2007, hlm. 1333.
- ^ a b HSM 2006.
- ^ Fischman 2001, hlm. 458–459.
- ^ El Saadi et al. 1989.
- ^ Roblin et al. 2006.
- ^ Hultén et al. 2004.
- ^ Zorich 1991, hlm. 182–183.
- ^ Liteplo et al. 2002, hlm. 100.
- ^ a b c d Shin & Silverberg 2013.
- ^ Reddy 2009.
- ^ Baez, Baez & Marthaler 2000.
- ^ a b Augenstein et al. 1991.
- ^ Gessner et al. 1994.
- ^ CDC 2013.
- ^ Shulman & Wells 1997.
- ^ Beck et al. 2011.
- ^ Aucamp & Björn 2010, hlm. 4–6, 41, 46–47.
- ^ Mitchell Crow 2011.
- ^ Barry & Phillips 2006.
- ^ EPA 2013a.
- ^ a b EPA 2013b.
- ^ McCoy 2007.
- ^ Forster et al. 2007, hlm. 212–213.
- ^ Schwarcz 2004, hlm. 37.
- ^ Giesy & Kannan 2002.
- ^ a b c d Steenland, Fletcher & Savitz 2010.
- ^ a b c d Betts 2007.
- ^ EPA 2012.
- ^ Zareitalabad et al. 2013.
- ^ a b Lau et al. 2007.
Referensi terindeks
- Agricola, Georgius; Hoover, Herbert Clark; Hoover, Lou Henry (1912). De Re Metallica. London: The Mining Magazine.
- Aigueperse, J.; Mollard, P.; Devilliers, D.; Chemla, M.; Faron, R.; Romano, R. E.; Cue, J. P. (2005), "Fluorine Compounds, Inorganic", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, hlm. 397–441, doi:10.1002/14356007
- Air Products and Chemicals (2004). "Safetygram #39 Chlorine Trifluoride" (PDF). Air Products and Chemicals. Diarsipkan dari versi asli (PDF) tanggal 18 Maret 2006. Diakses tanggal 4 Agustus 2022. Parameter
|url-status=yang tidak diketahui akan diabaikan (bantuan) - Alavi, Abbas; Huang, Steve S. (2007). "Positron Emission Tomography in Medicine: An Overview". Dalam Hayat, M. A. Cancer Imaging, Volume 1: Lung and Breast Carcinomas. Burlington: Academic Press. hlm. 39–44. ISBN 978-0-12-370468-9.
- Ampère, André-Marie (1816). "Suite d'une classification naturelle pour les corps simples". Annales de chimie et de physique (dalam bahasa Prancis). 2: 1–5.
- Arana, L. R.; Mas, N.; Schmidt, R.; Franz, A. J.; Schmidt, M. A.; Jensen, K. F. (2007). "Isotropic Etching of Silicon in Fluorine Gas for MEMS Micromachining". Journal of Micromechanics and Microengineering. 17 (2): 384–392. Bibcode:2007JMiMi..17..384A. doi:10.1088/0960-1317/17/2/026.
- Armfield, J. M. (2007). "When Public Action Undermines Public Health: A Critical Examination of Antifluoridationist Literature". Australia and New Zealand Health Policy. 4: 25. doi:10.1186/1743-8462-4-25. PMC 2222595
 . PMID 18067684. Diarsipkan dari versi asli tanggal 2016-01-27. Diakses tanggal 2022-08-04.
. PMID 18067684. Diarsipkan dari versi asli tanggal 2016-01-27. Diakses tanggal 2022-08-04. - Asimov, Isaac (1966). The Noble Gases. New York: Basic Books. ISBN 978-0-465-05129-8.
- Atkins, Peter; Jones, Loretta (2007). Chemical Principles: The Quest for Insight
 (edisi ke-4th). New York: W. H. Freeman. ISBN 978-1-4292-0965-6.
(edisi ke-4th). New York: W. H. Freeman. ISBN 978-1-4292-0965-6. - Aucamp, Pieter J.; Björn, Lars Olof (2010). "Questions and Answers about the Environmental Effects of the Ozone Layer Depletion and Climate Change: 2010 Update" (PDF). United Nations Environmental Programme. Diarsipkan dari versi asli (PDF) tanggal 3 September 2013. Diakses tanggal 4 Agustus 2022. Parameter
|url-status=yang tidak diketahui akan diabaikan (bantuan) - Audi, G.; Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S. (2017). "The NUBASE2016 evaluation of nuclear properties" (PDF). Chinese Physics C. 41 (3): 030001. Bibcode:2017ChPhC..41c0001A. doi:10.1088/1674-1137/41/3/030001. .
- Augenstein, W. L.; et al. (1991). "Fluoride Ingestion in Children: A Review of 87 cases". Pediatrics. 88 (5): 907–912. doi:10.1542/peds.88.5.907. PMID 1945630. Diarsipkan dari versi asli tanggal 2010-10-02. Diakses tanggal 2022-08-04. Parameter
|s2cid=yang tidak diketahui akan diabaikan (bantuan) - Babel, Dietrich; Tressaud, Alain (1985). "Crystal Chemistry of Fluorides". Dalam Hagenmuller, Paul. Inorganic Solid Fluorides: Chemistry And Physics. Orlando: Academic Press. hlm. 78–203. ISBN 978-0-12-412490-5.
- Baelum, Vibeke; Sheiham, Aubrey; Burt, Brian (2008). "Caries Control for Populations". Dalam Fejerskov, Ole; Kidd, Edwina. Dental Caries: The Disease and Its Clinical Management (edisi ke-2nd). Oxford: Blackwell Munksgaard. hlm. 505–526. ISBN 978-1-4051-3889-5.
- Baez, Ramon J.; Baez, Martha X.; Marthaler, Thomas M. (2000). "Urinary Fluoride Excretion by Children 4–6 Years Old in a South Texas Community". Revista Panamericana de Salud Pública. 7 (4): 242–248. doi:10.1590/S1020-49892000000400005
 . PMID 10846927.
. PMID 10846927. - Banks, R. E. (1986). "Isolation of fluorine by Moissan: Setting the scene". Journal of Fluorine Chemistry. 33 (1–4): 3–26. doi:10.1016/S0022-1139(00)85269-0.
- Barbee, K.; McCormack, K.; Vartanian, V. (2000). "EHS Concerns with Ozonated Water Spray Processing". Dalam Mendicino, L. Environmental Issues in the Electronics and Semiconductor Industries. Pennington, NJ: The Electrochemical Society. hlm. 108–121. ISBN 978-1-56677-230-3.
- Barrett, C. S.; Meyer, L.; Wasserman, J. (1967). "Argon—Fluorine Phase Diagram". The Journal of Chemical Physics. 47 (2): 740–743. Bibcode:1967JChPh..47..740B. doi:10.1063/1.1711946.
- Barry, Patrick L.; Phillips, Tony (26 May 2006). "Good News and a Puzzle". National Aeronautics and Space Administration. Diarsipkan dari versi asli tanggal 2010-05-27. Diakses tanggal 4 Agustus 2022.
- Bartlett, N. (1962). "Xenon Hexafluoroplatinate (V) Xe+[PtF6]−". Proceedings of the Chemical Society (6): 218. doi:10.1039/PS9620000197.
- Beasley, Michael (Agustus 2002). Guidelines for the safe use of sodium fluoroacetate (1080) (PDF). Wellington: Occupational Safety & Health Service, Department of Labour (New Zealand). ISBN 0-477-03664-3. Diarsipkan dari versi asli (PDF) tanggal 11 November 2013. Diakses tanggal 4 Agustus 2022. Parameter
|url-status=yang tidak diketahui akan diabaikan (bantuan) - Beck, Jefferson; Newman, Paul; Schindler, Trent L.; Perkins, Lori (2011). "What Would have Happened to the Ozone Layer if Chlorofluorocarbons (CFCs) had not been Regulated?". National Aeronautics and Space Administration. Diarsipkan dari versi asli tanggal 2020-08-04. Diakses tanggal 4 Agustus 2022.
- Becker, S.; Müller, B. G. (1990). "Vanadium Tetrafluoride". Angewandte Chemie International Edition in English. 29 (4): 406–407. doi:10.1002/anie.199004061.
- Bégué, Jean-Pierre; Bonnet-Delpon, Danièle (2008). Bioorganic and Medicinal Chemistry of Fluorine. Hoboken: John Wiley & Sons. ISBN 978-0-470-27830-7.
- Betts, K. S. (2007). "Perfluoroalkyl Acids: What is the Evidence Telling Us?". Environmental Health Perspectives. 115 (5): A250–A256. doi:10.1289/ehp.115-a250. PMC 1867999
 . PMID 17520044.
. PMID 17520044. - Bihary, Z.; Chaban, G. M.; Gerber, R. B. (2002). "Stability of a Chemically Bound Helium Compound in High-pressure Solid Helium". The Journal of Chemical Physics. 117 (11): 5105–5108. Bibcode:2002JChPh.117.5105B. doi:10.1063/1.1506150.
- Biller, José (2007). Interface of Neurology and Internal Medicine (edisi ke-illustrated). Philadelphia: Lippincott Williams & Wilkins. ISBN 978-0-7817-7906-7. Diarsipkan dari versi asli tanggal 2023-07-22. Diakses tanggal 2022-08-04.
- Blodgett, D. W.; Suruda, A. J.; Crouch, B. I. (2001). "Fatal Unintentional Occupational Poisonings by Hydrofluoric Acid in the U.S" (PDF). American Journal of Industrial Medicine. 40 (2): 215–220. doi:10.1002/ajim.1090. PMID 11494350. Diarsipkan dari versi asli (PDF) tanggal 17 Juli 2012. Parameter
|url-status=yang tidak diketahui akan diabaikan (bantuan) - Bombourg, Nicolas (4 July 2012). "World Fluorochemicals Market, Freedonia". Reporterlinker. Diarsipkan dari versi asli tanggal 2020-04-23. Diakses tanggal 4 Agustus 2022.
- Brantley, L. R. (1949). Squires, Roy; Clarke, Arthur C., ed. "Fluorine". Pacific Rockets: Journal of the Pacific Rocket Society. South Pasadena: Sawyer Publishing/Pacific Rocket Society Historical Library. 3 (1): 11–18. ISBN 978-0-9794418-5-1.
- Brody, Jane E. (10 September 2012). "Popular Antibiotics May Carry Serious Side Effects". The New York Times Well Blog. Diarsipkan dari versi asli tanggal 2020-08-06. Diakses tanggal 4 Agustus 2022.
- Brown, Paul L.; Mompean, Federico J.; Perrone, Jane; Illemassène, Myriam (2005). Chemical Thermodynamics of Zirconium. Amsterdam: Elsevier B. V. ISBN 978-0-444-51803-3.
- Burdon, J.; Emson, B.; Edwards, A. J. (1987). "Is Fluorine Gas Really Yellow?". Journal of Fluorine Chemistry. 34 (3–4): 471–474. doi:10.1016/S0022-1139(00)85188-X.
- Bürgi, H. B. (2000). "Motion and Disorder in Crystal Structure Analysis: Measuring and Distinguishing them". Annual Review of Physical Chemistry. 51: 275–296. Bibcode:2000ARPC...51..275B. doi:10.1146/annurev.physchem.51.1.275. PMID 11031283.
- Burney, H. (1999). "Past, Present and Future of the Chlor-Alkali Industry". Dalam Burney, H. S.; Furuya, N.; Hine, F.; Ota, K.-I. Chlor-Alkali and Chlorate Technology: R. B. MacMullin Memorial Symposium. Pennington: The Electrochemical Society. hlm. 105–126. ISBN 1-56677-244-3.
- Bustamante, E.; Pedersen, P. L. (1977). "High Aerobic Glycolysis of Rat Hepatoma Cells in Culture: Role of Mitochondrial Hexokinase". Proceedings of the National Academy of Sciences. 74 (9): 3735–3739. Bibcode:1977PNAS...74.3735B. doi:10.1073/pnas.74.9.3735
 . PMC 431708
. PMC 431708  . PMID 198801.
. PMID 198801. - Buznik, V. M. (2009). "Fluoropolymer Chemistry in Russia: Current Situation and Prospects". Russian Journal of General Chemistry. 79 (3): 520–526. doi:10.1134/S1070363209030335. Parameter
|s2cid=yang tidak diketahui akan diabaikan (bantuan) - Cameron, A. G. W. (1973). "Abundance of the Elements in the Solar System" (PDF). Space Science Reviews. 15 (1): 121–146. Bibcode:1973SSRv...15..121C. doi:10.1007/BF00172440. Diarsipkan dari versi asli (PDF) tanggal 21 Oktober 2011. Parameter
|s2cid=yang tidak diketahui akan diabaikan (bantuan); Parameter|url-status=yang tidak diketahui akan diabaikan (bantuan) - Carey, Charles W. (2008). African Americans in Science. Santa Barbara: ABC-CLIO. ISBN 978-1-85109-998-6.
- Carlson, D. P.; Schmiegel, W. (2005), "Fluoropolymers, Organic", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, hlm. 495–533, doi:10.1002/14356007.a11_393
- Centers for Disease Control and Prevention (2001). "Recommendations for Using Fluoride to Prevent and Control Dental Caries in the United States". MMWR Recommendations and Reports. 50 (RR–14): 1–42. PMID 11521913. Diarsipkan dari versi asli tanggal 2007-02-08. Diakses tanggal 4 Agustus 2022.
- Centers for Disease for Control and Prevention (10 Juli 2013). "Community Water Fluoridation". Diarsipkan dari versi asli tanggal 2017-07-05. Diakses tanggal 4 Agustus 2022.
- Chambers, C.; Holliday, A. K. (1975). Modern Inorganic Chemistry: An Intermediate Text (PDF). London: Butterworth & Co. ISBN 978-0-408-70663-6. Diarsipkan dari versi asli (PDF) tanggal 23 Maret 2013. Parameter
|url-status=yang tidak diketahui akan diabaikan (bantuan) - Chang, Raymond; Goldsby, Kenneth A. (2013). Chemistry (edisi ke-11th). New York: McGraw-Hill. ISBN 978-0-07-131787-0.
- Cheng, H.; Fowler, D. E.; Henderson, P. B.; Hobbs, J. P.; Pascolini, M. R. (1999). "On the Magnetic Susceptibility of Fluorine". The Journal of Physical Chemistry A. 103 (15): 2861–2866. Bibcode:1999JPCA..103.2861C. doi:10.1021/jp9844720.
- Cheng, K. K.; Chalmers, I.; Sheldon, T. A. (2007). "Adding Fluoride to Water Supplies" (PDF). BMJ. 335 (7622): 699–702. doi:10.1136/bmj.39318.562951.BE. PMC 2001050
 . PMID 17916854. Diarsipkan dari versi asli (PDF) tanggal 3 Maret 2016. Diakses tanggal 4 Agustus 2022. Parameter
. PMID 17916854. Diarsipkan dari versi asli (PDF) tanggal 3 Maret 2016. Diakses tanggal 4 Agustus 2022. Parameter |url-status=yang tidak diketahui akan diabaikan (bantuan) - Chisté, V.; Bé, M. M. (2011). "F-18" (PDF). Dalam Bé, M. M.; Coursol, N.; Duchemin, B.; Lagoutine, F.; et al. Table de radionucléides (Laporan). CEA (Commissariat à l'énergie atomique et aux énergies alternatives), LIST, LNE-LNHB (Laboratoire National Henri Becquerel/Commissariat à l'Energie Atomique). Diarsipkan dari versi asli (PDF) tanggal 2020-08-11. Diakses tanggal 4 Agustus 2022.
- Christe, Karl O. (1986). "Chemical Synthesis of Elemental Fluorine". Inorganic Chemistry. 25 (21): 3721–3722. doi:10.1021/ic00241a001.
- Christe Research Group (n.d.). "Chemical Synthesis of Elemental Fluorine". Diarsipkan dari versi asli tanggal 4 Maret 2016. Diakses tanggal 4 Agustus 2022. Parameter
|url-status=yang tidak diketahui akan diabaikan (bantuan) - Clark, Jim (2002). "The Acidity of the Hydrogen Halides". chemguide.co.uk. Diarsipkan dari versi asli tanggal 2012-05-31. Diakses tanggal 4 Agustus 2022.
- Clayton, Donald (2003). Handbook of Isotopes in the Cosmos: Hydrogen to Gallium. New York: Cambridge University Press. ISBN 978-0-521-82381-4.
- Compressed Gas Association (1999). Handbook of Compressed Gases (edisi ke-4). Boston: Kluwer Academic Publishers. ISBN 978-0-412-78230-5.
- Cordero, B.; Gómez, V.; Platero-Prats, A. E.; Revés, M.; Echeverría, J.; Cremades, E.; Barragán, F.; Alvarez, S. (2008). "Covalent Radii Revisited". Dalton Transactions (21): 2832–2838. doi:10.1039/b801115j. PMID 18478144.
- Cracher, Connie M. (2012). "Current Concepts in Preventive Dentistry" (PDF). dentalcare.com. Diarsipkan dari versi asli (PDF) tanggal 14 Oktober 2013. Diakses tanggal 4 Agustus 2022. Parameter
|url-status=yang tidak diketahui akan diabaikan (bantuan) - Croswell, Ken (September 2003). "Fluorine: An element–ary Mystery". Sky and Telescope. Diarsipkan dari versi asli tanggal 2016-03-04. Diakses tanggal 4 Agustus 2022.
- Mitchell Crow, James (2011). "First signs of ozone-hole recovery spotted". Nature. doi:10.1038/news.2011.293.
- Davis, Nicole (November 2006). "Better than blood". Popular Science. Diarsipkan dari versi asli tanggal 4 Juni 2011. Diakses tanggal 4 Agustus 2022.
- Davy, Humphry (1813). "Some experiments and observations on the substances produced in different chemical processes on fluor spar". Philosophical Transactions of the Royal Society. 103: 263–279. doi:10.1098/rstl.1813.0034
 .
. - Dean, John A. (1999). Lange's Handbook of Chemistry (edisi ke-15). New York: McGraw-Hill. ISBN 0-07-016190-9.
- DeBergalis, Michael (2004). "Fluoropolymer films in the photovoltaic industry". Journal of Fluorine Chemistry. 125 (8): 1255–1257. doi:10.1016/j.jfluchem.2004.05.013.
- Directorate-General for the Environment (European Commission) (2007). Trifluralin (PDF) (Laporan). European Commission. Diakses tanggal 4 Agustus 2022.
- Drews, T.; Supeł, J.; Hagenbach, A.; Seppelt, K. (2006). "Solid State Molecular Structures of Transition Metal Hexafluorides". Inorganic Chemistry. 45 (9): 3782–3788. doi:10.1021/ic052029f. PMID 16634614.
- DuPont (2013a). "Freon". Diarsipkan dari versi asli tanggal 2015-02-21. Diakses tanggal 4 Agustus 2022.
- DuPont (2013b). "Understanding the Refrigerant 'R' Nomenclature". Diarsipkan dari versi asli tanggal 2014-10-03. Diakses tanggal 4 Agustus 2022.
- Eaton, Charles (1997). "Figure hfl". E-Hand.com: The Electronic Textbook of Hand Surgery. The Hand Center (former practice of Dr. Eaton). Diarsipkan dari versi asli tanggal 2020-07-25. Diakses tanggal 4 Agustus 2022.
- Edwards, Philip Neil (1994). "Use of Fluorine in Chemotherapy". Dalam Banks, R. E.; Smart, B. E.; Tatlow, J. C. Organofluorine Chemistry: Principles and Commercial Applications. New York: Plenum Press. hlm. 501–542. ISBN 978-0-306-44610-8.
- Einstein, F. W. B.; Rao, P. R.; Trotter, J.; Bartlett, N. (1967). "The Crystal Structure of Gold Trifluoride". Journal of the Chemical Society A: Inorganic, Physical, Theoretical. 4: 478–482. doi:10.1039/J19670000478.
- Eisler, Ronald (1995). Sodium Monofluoroacetate (1080) Hazards to Fish, Wildlife and Invertebrates: A Synoptic Review (PDF) (Laporan). Patuxent Environmental Science Center (U.S. National Biological Service). Diakses tanggal 5 June 2011.
- Ellis, Brian (2001). Scientific Essentialism. Cambridge: Cambridge University Press. ISBN 978-0-521-80094-5.
- El-Kareh, Badih (1994). Fundamentals of Semiconductor Processing Technology. Norwell and Dordrecht: Kluwer Academic Publishers. ISBN 978-0-7923-9534-8.
- El Saadi, M. S.; Hall, A. H.; Hall, P. K.; Riggs, B. S.; Augenstein, W. L.; Rumack, B. H. (1989). "Hydrofluoric Acid Dermal Exposure". Veterinary and Human Toxicology. 31 (3): 243–247. PMID 2741315.
- Emeléus, H. J.; Sharpe, A. G. (1974). Advances in Inorganic Chemistry and Radiochemistry. 16. New York: Academic Press. ISBN 978-0-08-057865-1.
- Emeléus, H. J.; Sharpe, A. G. (1983). Advances in Inorganic Chemistry and Radiochemistry. 27. Academic Press. ISBN 0-12-023627-3.
- Emsley, John (1981). "The Hidden Strength of Hydrogen". New Scientist. 91 (1264): 291–292. Diarsipkan dari versi asli tanggal 2023-07-22. Diakses tanggal 2022-08-04.
- Emsley, John (2011). Nature's Building Blocks: An A–Z Guide to the Elements (edisi ke-2). Oxford: Oxford University Press. ISBN 978-0-19-960563-7.
- Energetics, Inc. (1997). Energy and Environmental Profile of the U.S. Aluminum Industry (PDF) (Laporan). Diakses tanggal 4 Agustus 2022.
- Filler, R.; Saha, R. (2009). "Fluorine in Medicinal Chemistry: A Century of Progress and a 60-year Retrospective of Selected Highlights" (PDF). Future Medicinal Chemistry. 1 (5): 777–791. doi:10.4155/fmc.09.65. PMID 21426080. Diarsipkan dari versi asli (PDF) tanggal 22 Oktober 2013. Parameter
|url-status=yang tidak diketahui akan diabaikan (bantuan) - Fischman, Michael L. (2001). "Semiconductor Manufacturing Hazards". Dalam Sullivan, John B.; Krieger, Gary R. Clinical Environmental Health and Toxic Exposures (edisi ke-2nd). Philadelphia: Lippincott Williams & Wilkins. hlm. 431–465. ISBN 978-0-683-08027-8.
- Food and Nutrition Board. "Dietary Reference Intakes (DRIs): Recommended Dietary Allowances and Adequate Intakes, Elements" (PDF). Institute of Medicine, National Academies. Diarsipkan dari versi asli (PDF) tanggal 13 November 2018. Diakses tanggal 4 Agustus 2022.
- Forster, P.; Ramaswamy, V.; Artaxo, P.; Berntsen, T.; Betts, R.; Fahey, D. W.; Haywood, J.; Lean, J.; Lowe, D. C.; Myhre, G.; Nganga, J.; Prinn, R.; Raga, G.; Schulz, M.; Van Dorland, R. (2007). "Changes in Atmospheric Constituents and in Radiative Forcing". Dalam Solomon, S.; Manning, M.; Chen, Z.; Marquis, M.; Averyt, K. B.; Tignor, M.; Miller, H. L. Climate Change 2007: The Physical Science Basis. Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge: Cambridge University. hlm. 129–234. ISBN 978-0-521-70596-7.
- Fulton, Robert B.; Miller, M. Michael (2006). "Fluorspar". Dalam Kogel, Jessica Elzea; Trivedi, Nikhil C.; Barker, James M.; Krukowski, Stanley T. Industrial Minerals & Rocks: Commodities, Markets, and Uses. Littleton: Society for Mining, Metallurgy, and Exploration (U.S.). hlm. 461–473. ISBN 978-0-87335-233-8.
- Gabriel, J. L.; Miller Jr, T. F.; Wolfson, M. R.; Shaffer, T. H. (1996). "Quantitative Structure-Activity Relationships of Perfluorinated Hetero-Hydrocarbons as Potential Respiratory Media". ASAIO Journal. 42 (6): 968–973. doi:10.1097/00002480-199642060-00009. PMID 8959271. Parameter
|s2cid=yang tidak diketahui akan diabaikan (bantuan) - Gains, Paul (18 October 1998). "A New Threat in Blood Doping". The New York Times. Diarsipkan dari versi asli tanggal 2023-04-07. Diakses tanggal 4 Agustus 2022.
- Gessner, B. D.; Beller, M.; Middaugh, J. P.; Whitford, G. M. (1994). "Acute Fluoride Poisoning from a Public Water System". New England Journal of Medicine. 330 (2): 95–99. doi:10.1056/NEJM199401133300203. PMID 8259189.
- Giesy, J. P.; Kannan, K. (2002). "Perfluorochemical Surfactants in the Environment". Environmental Science & Technology. 36 (7): 146A–152A. Bibcode:2002EnST...36..146G. doi:10.1021/es022253t
 . PMID 11999053.
. PMID 11999053. - Godfrey, S. M.; McAuliffe, C. A.; Mackie, A. G.; Pritchard, R. G. (1998). "Inorganic Derivatives of the Elements". Dalam Norman, Nicholas C. Chemistry of Arsenic, Antimony and Bismuth. London: Blackie Academic & Professional. hlm. 67–158. ISBN 978-0-7514-0389-3.
- Green, S. W.; Slinn, D. S. L.; Simpson, R. N. F.; Woytek, A. J. (1994). "Perfluorocarbon Fluids". Dalam Banks, R. E.; Smart, B. E.; Tatlow, J. C. Organofluorine Chemistry: Principles and Applications. New York: Plenum Press. hlm. 89–119. ISBN 978-0-306-44610-8.
- Greenwood, N. N.; Earnshaw, A. (1998). Chemistry of the Elements (edisi ke-2nd). Oxford: Butterworth Heinemann. ISBN 0-7506-3365-4.
- Gribble, G. W. (2002). "Naturally Occurring Organofluorines". Dalam Neison, A. H. Organofluorines. The Handbook of Environmental Chemistry. 3N. Berlin: Springer. hlm. 121–136. doi:10.1007/10721878_5. ISBN 3-540-42064-9.
- Grot, Walter (2011). Fluorinated Ionomers (edisi ke-2). Oxford and Waltham: Elsevier. ISBN 978-1-4377-4457-6.
- Hagmann, W. K. (2008). "The Many Roles for Fluorine in Medicinal Chemistry". Journal of Medicinal Chemistry. 51 (15): 4359–4369. doi:10.1021/jm800219f. PMID 18570365.
- Harbison, G. S. (2002). "The Electric Dipole Polarity of the Ground and Low-lying Metastable Excited States of NF". Journal of the American Chemical Society. 124 (3): 366–367. doi:10.1021/ja0159261. PMID 11792193.
- Hasegawa, Y.; Otani, R.; Yonezawa, S.; Takashima, M. (2007). "Reaction Between Carbon Dioxide and Elementary Fluorine". Journal of Fluorine Chemistry. 128 (1): 17–28. doi:10.1016/j.jfluchem.2006.09.002. hdl:10098/1665
 . Parameter
. Parameter |s2cid=yang tidak diketahui akan diabaikan (bantuan) - Haxel, G. B.; Hedrick, J. B.; Orris, G. J. (2005). Stauffer, P. H.; Hendley II, J. W., ed. Rare Earth Elements—Critical Resources for High Technology, Fact Sheet 087-02 (Laporan). U.S. Geological Survey. Diakses tanggal 4 Agustus 2022.
- Haynes, William M., ed. (2011). Handbook of Chemistry and Physics (edisi ke-92). Boca Raton: CRC Press. ISBN 978-1-4398-5511-9.
- Hoffman, Robert; Nelson, Lewis; Howland, Mary; Lewin, Neal; Flomenbaum, Neal; Goldfrank, Lewis (2007). Goldfrank's Manual of Toxicologic Emergencies. New York: McGraw-Hill Professional. ISBN 978-0-07-144310-4.
- Honeywell (2006). Recommended medical treatment for hydrofluoric acid exposure (PDF). Morristown: Honeywell International. Diarsipkan dari versi asli (PDF) tanggal 8 Oktober 2013. Diakses tanggal 4 Agustus 2022. Parameter
|url-status=yang tidak diketahui akan diabaikan (bantuan) - Hoogers, G. (2002). "Fuel Cell Components and Their Impact on Performance". Dalam Hoogers, G. Fuel Cell Technology Handbook. Boca Raton: CRC Press. hlm. 4–1–4–27. ISBN 0-8493-0877-1.
- Hounshell, David A.; Smith, John Kelly (1988). Science and Corporate Strategy: DuPont R & D, 1902–1980. Cambridge: Cambridge University Press. ISBN 0-521-32767-9.
- Hultén, P.; Höjer, J.; Ludwigs, U.; Janson, A. (2004). "Hexafluorine vs. Standard Decontamination to Reduce Systemic Toxicity After Dermal Exposure to Hydrofluoric Acid". Clinical Toxicology. 42 (4): 355–361. doi:10.1081/CLT-120039541. PMID 15461243. Parameter
|s2cid=yang tidak diketahui akan diabaikan (bantuan) - ICIS (2 October 2006). "Fluorine's Treasure Trove". Reed Business Information. Diarsipkan dari versi asli tanggal 2009-02-26. Diakses tanggal 4 Agustus 2022.
- Jaccaud, M.; Faron, R.; Devilliers, D.; Romano, R. (2005), "Fluorine", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, hlm. 381–395, doi:10.1002/14356007.a11_293
- Johnson, Linda A. (28 Desember 2011). "Against Odds, Lipitor Became World's Top Seller". The Boston Globe. Diarsipkan dari versi asli tanggal 2016-03-04. Diakses tanggal 4 Agustus 2022.
- Kacmarek, Robert M.; Wiedemann, Herbert P.; Lavin, Philip T.; Wedel, Mark K.; Tütüncü, Ahmet S.; Slutsky, Arthur S. (2006). "Partial Liquid Ventilation in Adult Patients with Acute Respiratory Distress Syndrome". American Journal of Respiratory and Critical Care Medicine. 173 (8): 882–9. doi:10.1164/rccm.200508-1196OC. PMID 16254269.
- Katakuse, Itsuo; Ichihara, Toshio; Ito, Hiroyuki; Sakurai, Tohru; Matsuo, Takekiyo (1999). "SIMS Experiment". Dalam Arai, T.; Mihama, K.; Yamamoto, K.; Sugano, S. Mesoscopic Materials and Clusters: Their Physical and Chemical Properties. Tokyo: Kodansha. hlm. 259–273. ISBN 4-06-208635-2.
- Kelly, T. D.; Miller, M. M. (2005). "Historical Fluorspar Statistics". U.S. Geological Service. Diarsipkan dari versi asli tanggal 2013-05-22. Diakses tanggal 4 Agustus 2022.
- Keplinger, M. L.; Suissa, L. W. (1968). "Toxicity of Fluorine Short-Term Inhalation". American Industrial Hygiene Association Journal. 29 (1): 10–18. doi:10.1080/00028896809342975. PMID 5667185.
- Kern, S.; Hayward, J.; Roberts, S.; Richardson, J. W.; Rotella, F. J.; Soderholm, L.; Cort, B.; Tinkle, M.; West, M.; Hoisington, D.; Lander, G. A. (1994). "Temperature Variation of the Structural Parameters in Actinide Tetrafluorides". The Journal of Chemical Physics. 101 (11): 9333–9337. Bibcode:1994JChPh.101.9333K. doi:10.1063/1.467963. Diarsipkan dari versi asli tanggal 2021-04-14. Diakses tanggal 2022-08-04. <
- Khriachtchev, L.; Pettersson, M.; Runeberg, N.; Lundell, J.; Räsänen, M. (2000). "A Stable Argon Compound". Nature. 406 (6798): 874–876. Bibcode:2000Natur.406..874K. doi:10.1038/35022551. PMID 10972285. Diarsipkan dari versi asli tanggal 2016-04-13. Diakses tanggal 2022-08-04. Parameter
|s2cid=yang tidak diketahui akan diabaikan (bantuan) - King, D. E.; Malone, R.; Lilley, S. H. (2000). "New Classification and Update on the Quinolone Antibiotics". American Family Physician. 61 (9): 2741–2748. PMID 10821154. Diarsipkan dari versi asli tanggal 2020-08-06. Diakses tanggal 4 Agustus 2022.
- Kirsch, Peer (2004). Modern Fluoroorganic Chemistry: Synthesis, Reactivity, Applications. Weinheim: Wiley-VCH. ISBN 978-3-527-30691-6.
- Kissa, Erik (2001). Fluorinated Surfactants and Repellents (edisi ke-2nd). New York: Marcel Dekker. ISBN 978-0-8247-0472-8.
- Kuriakose, A. K.; Margrave, J. L. (1965). "Kinetics of the Reactions of Elemental Fluorine. IV. Fluorination of Graphite". Journal of Physical Chemistry. 69 (8): 2772–2775. doi:10.1021/j100892a049.
- Lagow, R. J. (1970). The Reactions of Elemental Fluorine; A New Approach to Fluorine Chemistry (Tesis PhD, Rice University, TX). Ann Arbor: UMI. http://scholarship.rice.edu/bitstream/handle/1911/16744/9514194.PDF.
- Lau, C.; Anitole, K.; Hodes, C.; Lai, D.; Pfahles-Hutchens, A.; Seed, J. (2007). "Perfluoroalkyl Acids: A Review of Monitoring and Toxicological Findings". Toxicological Sciences. 99 (2): 366–394. doi:10.1093/toxsci/kfm128
 . PMID 17519394.
. PMID 17519394. - Lee, Stephen; et al. (2014). "Monofluoroacetate-Containing Plants That Are Potentially Toxic to Livestock". Journal of Agricultural and Food Chemistry. ACS Publications. 62 (30): 7345–7354. doi:10.1021/jf500563h. PMID 24724702.
- Lewars, Errol G. (2008). Modeling Marvels: Computational Anticipation of Novel Molecules. Dordrecht: Springer. ISBN 978-1-4020-6972-7. Diarsipkan dari versi asli tanggal 2023-07-22. Diakses tanggal 2022-08-04.
- Lide, David R. (2004). Handbook of Chemistry and Physics
 (edisi ke-84). Boca Raton: CRC Press. ISBN 0-8493-0566-7.
(edisi ke-84). Boca Raton: CRC Press. ISBN 0-8493-0566-7. - Lidin, R.; Molochko, V. A.; Andreeva, L. L. (2000). Химические свойства неорганических веществ [Chemical Properties of Inorganic Substances] (dalam bahasa Rusia). Moscow: Khimiya. ISBN 5-7245-1163-0.
- Liteplo, R.; Gomes, R.; Howe, P.; Malcolm, H. (2002). Environmental Health Criteria 227 (Fluoride). Geneva: United Nations Environment Programme; International Labour Organization; World Health Organization. ISBN 92-4-157227-2. Diarsipkan dari versi asli tanggal 2020-01-12. Diakses tanggal 4 Agustus 2022.
- Lusty, P. A. J.; Brown, T. J.; Ward, J.; Bloomfield, S. (2008). "The Need for Indigenous Fluorspar Production in England". British Geological Survey. Diarsipkan dari versi asli tanggal 2016-08-07. Diakses tanggal 4 Agustus 2022.
- Mackay, Kenneth Malcolm; Mackay, Rosemary Ann; Henderson, W. (2002). Introduction to Modern Inorganic Chemistry (edisi ke-6th). Cheltenham: Nelson Thornes. ISBN 0-7487-6420-8.
- Macomber, Roger (1996). Organic chemistry. 1. Sausalito: University Science Books. ISBN 978-0-935702-90-3.
- Marggraf, Andreas Sigismun (1770). "Observation concernant une volatilisation remarquable d'une partie de l'espece de pierre, à laquelle on donne les noms de flosse, flüsse, flus-spaht, et aussi celui d'hesperos; laquelle volatilisation a été effectuée au moyen des acides" [Observation of a remarkable volatilization of part of a type of stone to which one gives the name flosse, flüsse, flus-spaht, as well as that of hesperos; which volatilization was effected by means of acids]. Mémoires de l'Académie royale des sciences et belles-lettres (dalam bahasa Prancis). XXIV: 3–11.
- Martin, John W., ed. (2007). Concise Encyclopedia of the Structure of Materials. Oxford and Amsterdam: Elsevier. ISBN 978-0-08-045127-5.
- Marya, C. M. (2011). A Textbook of Public Health Dentistry. New Delhi: Jaypee Brothers Medical Publishers. ISBN 978-93-5025-216-1.
- Matsui, M. (2006). "Fluorine-containing Dyes". Dalam Kim, Sung-Hoon. Functional dyes. Orlando: Academic Press. hlm. 257–266. ISBN 978-0-12-412490-5.
- Meusinger, Reinhard; Chippendale, A. Margaret; Fairhurst, Shirley A. (2005), "Nuclear Magnetic Resonance and Electron Spin Resonance Spectroscopy", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, hlm. 609–660, doi:10.1002/14356007.b05_471
- Meyer, Eugene (1977). Chemistry of Hazardous Materials. Englewood Cliffs: Prentice Hall. ISBN 978-0-13-129239-0.
- Miller, M. Michael (2003a). "Fluorspar" (PDF). U.S. Geological Survey Minerals Yearbook. U.S. Geological Survey. hlm. 27.1–27.12. Diarsipkan (PDF) dari versi asli tanggal 2004-11-01. Diakses tanggal 2022-08-04.
- Miller, M. Michael (2003b). "Mineral Resource of the Month, Fluorspar" (PDF). U.S. Geological Survey. Diarsipkan (PDF) dari versi asli tanggal 2017-02-17. Diakses tanggal 4 Agustus 2022.
- Mitchell, E. Siobhan (2004). Antidepressants
 . New York: Chelsea House Publishers. ISBN 978-1-4381-0192-7.
. New York: Chelsea House Publishers. ISBN 978-1-4381-0192-7. - Moeller, T.; Bailar, J. C.; Kleinberg (1980). Chemistry, with Inorganic Qualitative Analysis (edisi ke-3). New York: Academic Press. ISBN 0-12-503350-8.
- Moissan, Henri (1886). "Action d'un courant électrique sur l'acide fluorhydrique anhydre". Comptes rendus hebdomadaires des séances de l'Académie des sciences (dalam bahasa Prancis). 102: 1543–1544. Diarsipkan dari versi asli tanggal 2020-08-06. Diakses tanggal 4 Agustus 2022.
- McCoy, M. (2007). "SURVEY Market Challenges Dim the Confidence of the World's Chemical CEOs". Chemical & Engineering News. 85 (23): 11. doi:10.1021/cen-v085n023.p011a.
- Moore, John W.; Stanitski, Conrad L.; Jurs, Peter C. (2010). Principles of Chemistry: The Molecular Science. Belmont: Brooks/Cole. ISBN 978-0-495-39079-4.
- Morrow, S. I.; Perry, D. D.; Cohen, M. S. (1959). "The Formation of Dinitrogen Tetrafluoride in the Reaction of Fluorine and Ammonia". Journal of the American Chemical Society. 81 (23): 6338–6339. doi:10.1021/ja01532a066.
- Müller, Peter (2009). "5.067 Crystal Structure Refinement" (PDF). Cambridge: MIT OpenCourseWare. Diarsipkan (PDF) dari versi asli tanggal 2020-08-06. Diakses tanggal 4 Agustus 2022.
- Murphy, C. D.; Schaffrath, C.; O'Hagan, D. (2003). "Fluorinated Natural Products: The Biosynthesis of Fluoroacetate and 4-Fluorothreonine in Streptomyces cattleya". Chemosphere. 52 (2): 455–461. Bibcode:2003Chmsp..52..455M. doi:10.1016/S0045-6535(03)00191-7. PMID 12738270.
- Murthy, C. Parameshwara; Mehdi Ali, S. F.; Ashok, D. (1995). University Chemistry. I. New Delhi: New Age International. ISBN 978-81-224-0742-6.
- National Health and Medical Research Council (2007). A Systematic Review of the Efficacy and Safety of Fluoridation, Part A: Review of Methodology and Results (PDF). Canberra: Australian Government. ISBN 978-1-86496-421-9. Diarsipkan dari versi asli (PDF) tanggal 13 Januari 2012. Diakses tanggal 4 Agustus 2022. Parameter
|url-status=yang tidak diketahui akan diabaikan (bantuan) - The National Institute for Occupational Safety and Health (1994). "Fluorine". Documentation for Immediately Dangerous To Life or Health Concentrations (IDLHs). Diarsipkan dari versi asli tanggal 2022-12-08. Diakses tanggal 15 January 2014.
- The National Institute for Occupational Safety and Health (1994). "Chlorine". Documentation for Immediately Dangerous To Life or Health Concentrations (IDLHs). Diarsipkan dari versi asli tanggal 2023-02-05. Diakses tanggal 4 Agustus 2022.
- National Nuclear Data Center. "NuDat 2.1 Database". Brookhaven National Laboratory. Diarsipkan dari versi asli tanggal 2019-05-13. Diakses tanggal 4 Agustus 2022.
- National Oceanic and Atmospheric Administration. "UN/NA 1045 (United Nations/North America Fluorine Data Sheet)". Diarsipkan dari versi asli tanggal 2014-02-25. Diakses tanggal 4 Agustus 2022.
- Navarrini, Walter; Venturini, Francesco; Tortelli, Vito; Basak, Soubir; Pimparkar, Ketan P.; Adamo, Andrea; Jensen, Klavs F. (2012). "Direct fluorination of carbon monoxide in microreactors". Journal of Fluorine Chemistry. 142: 19–23. doi:10.1016/j.jfluchem.2012.06.006.
- Nelson, Eugene W. (1947). "'Bad Man' of The Elements". Popular Mechanics. 88 (2): 106–108, 260. Diarsipkan dari versi asli tanggal 2023-07-22. Diakses tanggal 2022-08-04.
- Nelson, J. M.; Chiller, T. M.; Powers, J. H.; Angulo, F. J. (2007). "Food Safety: Fluoroquinolone‐ResistantCampylobacterSpecies and the Withdrawal of Fluoroquinolones from Use in Poultry: A Public Health Success Story" (PDF). Clinical Infectious Diseases. 44 (7): 977–980. doi:10.1086/512369
 . PMID 17342653. Diarsipkan (PDF) dari versi asli tanggal 2022-09-01. Diakses tanggal 2022-08-04.
. PMID 17342653. Diarsipkan (PDF) dari versi asli tanggal 2022-09-01. Diakses tanggal 2022-08-04. - Nielsen, Forrest H. (2009). "Micronutrients in Parenteral Nutrition: Boron, Silicon, and Fluoride". Gastroenterology. 137 (5): S55–60. doi:10.1053/j.gastro.2009.07.072. PMID 19874950. Diarsipkan dari versi asli tanggal 2020-07-30. Diakses tanggal 4 Agustus 2022.
- Norwood, Charles J.; Fohs, F. Julius (1907). Kentucky Geological Survey, Bulletin No. 9: Fluorspar Deposits of Kentucky. Kentucky Geological Survey.
- Noury, S.; Silvi, B.; Gillespie, R. J. (2002). "Chemical Bonding in Hypervalent Molecules: Is the Octet Rule Relevant?" (PDF). Inorganic Chemistry. 41 (8): 2164–2172. doi:10.1021/ic011003v. PMID 11952370. Diarsipkan dari versi asli tanggal 2020-05-11. Diakses tanggal 4 Agustus 2022.
- O'Hagan, D. (2008). "Understanding Organofluorine Chemistry. An Introduction to the C–F Bond". Chemical Society Reviews. 37 (2): 308–319. doi:10.1039/b711844a. PMID 18197347.
- O'Hagan, D.; Schaffrath, C.; Cobb, S. L.; Hamilton, J. T. G.; Murphy, C. D. (2002). "Biochemistry: Biosynthesis of an Organofluorine Molecule". Nature. 416 (6878): 279. Bibcode:2002Natur.416..279O. doi:10.1038/416279a
 . PMID 11907567. Parameter
. PMID 11907567. Parameter |s2cid=yang tidak diketahui akan diabaikan (bantuan) - Okada, T.; Xie, G.; Gorseth, O.; Kjelstrup, S.; Nakamura, N.; Arimura, T. (1998). "Ion and Water Transport Characteristics of Nafion Membranes as Electrolytes". Electrochimica Acta. 43 (24): 3741–3747. doi:10.1016/S0013-4686(98)00132-7.
- Okazoe, T. (2009). "Overview on the History of Organofluorine Chemistry from the Viewpoint of Material Industry". Proceedings of the Japan Academy, Series B. 85 (8): 276–289. Bibcode:2009PJAB...85..276O. doi:10.2183/pjab.85.276. PMC 3621566
 . PMID 19838009. Diarsipkan dari versi asli tanggal 2020-08-06. Diakses tanggal 2022-08-04.
. PMID 19838009. Diarsipkan dari versi asli tanggal 2020-08-06. Diakses tanggal 2022-08-04. - Olivares, M.; Uauy, R. (2004). Essential Nutrients in Drinking Water (Draft) (PDF) (Laporan). World Health Organization (WHO). Diarsipkan dari versi asli (PDF) tanggal 19 Oktober 2012. Diakses tanggal 4 Agustus 2022. Parameter
|url-status=yang tidak diketahui akan diabaikan (bantuan) - Parente, Luca (2001). "The Development of Synthetic Glucocorticoids". Dalam Goulding, Nicolas J.; Flower, Rod J. Glucocorticoids. Basel: Birkhäuser. hlm. 35–53. ISBN 978-3-7643-6059-7.
- Partington, J. R. (1923). "The early history of hydrofluoric acid". Memoirs and Proceedings of the Manchester Literary and Philosophical Society. 67 (6): 73–87.
- Patnaik, Pradyot (2007). A Comprehensive Guide to the Hazardous Properties of Chemical Substances (edisi ke-3rd). Hoboken: John Wiley & Sons. ISBN 978-0-471-71458-3.
- Pauling, Linus (1960). The Nature of the Chemical Bond
 (edisi ke-3rd). Ithaca: Cornell University Press. ISBN 978-0-8014-0333-0.
(edisi ke-3rd). Ithaca: Cornell University Press. ISBN 978-0-8014-0333-0. - Pauling, L.; Keaveny, I.; Robinson, A. B. (1970). "The Crystal Structure of α-Fluorine". Journal of Solid State Chemistry. 2 (2): 225–227. Bibcode:1970JSSCh...2..225P. doi:10.1016/0022-4596(70)90074-5.
- Perry, Dale L. (2011). Handbook of Inorganic Compounds (edisi ke-2nd). Boca Raton: CRC Press. ISBN 978-1-4398-1461-1.
- Pitzer, K. S. (1975). "Fluorides of Radon and Element 118". Journal of the Chemical Society, Chemical Communications (18): 760b–761. doi:10.1039/C3975000760B. Diarsipkan dari versi asli tanggal 2021-12-08. Diakses tanggal 2022-08-04.
- Pitzer, Kenneth S., ed. (1993). Molecular Structure and Statistical Thermodynamics: Selected Papers of Kenneth S. Pitzer. Singapore: World Scientific Publishing. ISBN 978-981-02-1439-5.
- Pizzo, G.; Piscopo, M. R.; Pizzo, I.; Giuliana, G. (2007). "Community Water Fluoridation and Caries Prevention: A Critical Review" (PDF). Clinical Oral Investigations. 11 (3): 189–193. doi:10.1007/s00784-007-0111-6. PMID 17333303. Diarsipkan (PDF) dari versi asli tanggal 2020-07-24. Diakses tanggal 2022-08-04. Parameter
|s2cid=yang tidak diketahui akan diabaikan (bantuan) - Posner, Stefan (2011). "Perfluorinated Compounds: Occurrence and Uses in Products". Dalam Knepper, Thomas P.; Large, Frank T. Polyfluorinated Chemicals and Transformation Products. Heidelberg: Springer Science+Business Media. hlm. 25–40. ISBN 978-3-642-21871-2.
- Posner, Stefan; et al. (2013). Per- and Polyfluorinated Substances in the Nordic Countries: Use Occurrence and Toxicology (PDF). Copenhagen: Nordic Council of Ministers. doi:10.6027/TN2013-542. ISBN 978-92-893-2562-2. Diarsipkan (PDF) dari versi asli tanggal 2023-07-09. Diakses tanggal 2022-08-04.
- Preskorn, Sheldon H. (1996). Clinical Pharmacology of Selective Serotonin Reuptake Inhibitors. Caddo: Professional Communications. ISBN 978-1-884735-08-0.
- Principe, Lawrence M. (2012). The Secrets of Alchemy. Chicago: University of Chicago Press. ISBN 978-0-226-68295-2.
- Proudfoot, A. T.; Bradberry, S. M.; Vale, J. A. (2006). "Sodium Fluoroacetate Poisoning". Toxicological Reviews. 25 (4): 213–219. doi:10.2165/00139709-200625040-00002. PMID 17288493. Parameter
|s2cid=yang tidak diketahui akan diabaikan (bantuan) - PRWeb (28 October 2010). "Global Fluorochemicals Market to Exceed 2.6 Million Tons by 2015, According to a New Report by Global Industry Analysts, Inc". prweb.com. Diarsipkan dari versi asli tanggal 2020-07-31. Diakses tanggal 24 October 2013.
- PRWeb (23 February 2012). "Global Fluorspar Market to Reach 5.94 Million Metric Tons by 2017, According to New Report by Global Industry Analysts, Inc". prweb.com. Diarsipkan dari versi asli tanggal 2020-07-31. Diakses tanggal 24 October 2013.
- PRWeb (7 April 2013). "Fluoropolymers Market is Poised to Grow at a CAGR of 6.5% & to Reach $9,446.0 Million by 2016 – New report by MarketsandMarkets". prweb.com. Diarsipkan dari versi asli tanggal 2020-07-31. Diakses tanggal 24 October 2013.
- Pyykkö, Pekka; Atsumi, Michiko (2009). "Molecular Double-Bond Covalent Radii for Elements Li–E112". Chemistry: A European Journal. 15 (46): 12770–9. doi:10.1002/chem.200901472. PMID 19856342.
- Raghavan, P. S. (1998). Concepts and Problems in Inorganic Chemistry. Delhi: Discovery Publishing House. ISBN 978-81-7141-418-5.
- Raj, P. Prithvi; Erdine, Serdar (2012). Pain-Relieving Procedures: The Illustrated Guide. Chichester: John Wiley & Sons. ISBN 978-0-470-67038-5.
- Ramkumar, Jayshree (2012). "Nafion Perfluorosulphonate Membrane: Unique Properties and Various Applications". Dalam Banerjee, S.; Tyagi, A. K. Functional Materials: Preparation, Processing and Applications. London and Waltham: Elsevier. hlm. 549–578. ISBN 978-0-12-385142-0.
- Reddy, D. (2009). "Neurology of Endemic Skeletal Fluorosis". Neurology India. 57 (1): 7–12. doi:10.4103/0028-3886.48793. PMID 19305069. Diarsipkan dari versi asli tanggal 2021-11-05. Diakses tanggal 2022-08-04.
- Renda, Agostino; Fenner, Yeshe; Gibson, Brad K.; Karakas, Amanda I.; Lattanzio, John C.; Campbell, Simon; Chieffi, Alessandro; Cunha, Katia; Smith, Verne V. (2004). "On the origin of fluorine in the Milky Way". Monthly Notices of the Royal Astronomical Society. 354 (2): 575–580. arXiv:astro-ph/0410580
 . Bibcode:2004MNRAS.354..575R. doi:10.1111/j.1365-2966.2004.08215.x. Parameter
. Bibcode:2004MNRAS.354..575R. doi:10.1111/j.1365-2966.2004.08215.x. Parameter |s2cid=yang tidak diketahui akan diabaikan (bantuan) - Renner, R. (2006). "The Long and the Short of Perfluorinated Replacements". Environmental Science & Technology. 40 (1): 12–13. Bibcode:2006EnST...40...12R. doi:10.1021/es062612a
 . PMID 16433328.
. PMID 16433328. - Rhoades, David Walter (2008). Broadband Dielectric Spectroscopy Studies of Nafion (PhD dissertation, University of Southern Mississippi, MS). Ann Arbor. ISBN 978-0-549-78540-8.
- Richter, M.; Hahn, O.; Fuchs, R. (2001). "Purple Fluorite: A Little Known Artists' Pigment and Its Use in Late Gothic and Early Renaissance Painting in Northern Europe". Studies in Conservation. 46 (1): 1–13. doi:10.1179/sic.2001.46.1.1. JSTOR 1506878. Parameter
|s2cid=yang tidak diketahui akan diabaikan (bantuan) - Riedel, Sebastian; Kaupp, Martin (2009). "The highest oxidation states of the transition metal elements". Coordination Chemistry Reviews. 253 (5–6): 606–624. doi:10.1016/j.ccr.2008.07.014.
- Ripa, L. W. (1993). "A Half-century of Community Water Fluoridation in the United States: Review and Commentary" (PDF). Journal of Public Health Dentistry. 53 (1): 17–44. doi:10.1111/j.1752-7325.1993.tb02666.x. PMID 8474047. Diarsipkan dari versi asli (PDF) tanggal 4 March 2009. Parameter
|url-status=yang tidak diketahui akan diabaikan (bantuan) - Roblin, I.; Urban, M.; Flicoteau, D.; Martin, C.; Pradeau, D. (2006). "Topical Treatment of Experimental Hydrofluoric Acid Skin Burns by 2.5% Calcium Gluconate". Journal of Burn Care & Research. 27 (6): 889–894. doi:10.1097/01.BCR.0000245767.54278.09. PMID 17091088. Parameter
|s2cid=yang tidak diketahui akan diabaikan (bantuan) - Salager, Jean-Louis (2002). Surfactants: Types and Uses (PDF). FIRP Booklet # 300-A. Laboratory of Formulation, Interfaces, Rheology, and Processes, Universidad de los Andes. Diarsipkan (PDF) dari versi asli tanggal 2020-07-31. Diakses tanggal 13 October 2013.
- Sandford, Graham (2000). "Organofluorine Chemistry". Philosophical Transactions. 358 (1766): 455–471. Bibcode:2000RSPTA.358..455S. doi:10.1098/rsta.2000.0541. Parameter
|s2cid=yang tidak diketahui akan diabaikan (bantuan) - Sarkar, S. (2008). "Artificial Blood". Indian Journal of Critical Care Medicine. 12 (3): 140–144. doi:10.4103/0972-5229.43685. PMC 2738310
 . PMID 19742251.
. PMID 19742251. - Scheele, Carl Wilhelm (1771). "Undersŏkning om fluss-spat och dess syra" [Investigation of Fluorite and Its Acid]. Kungliga Svenska Vetenskapsademiens Handlingar [Proceedings of the Royal Swedish Academy of Science] (dalam bahasa Swedia). 32: 129–138.
- Schimmeyer, S. (2002). "The Search for a Blood Substitute". Illumin. Columbia: University of Southern Carolina. 15 (1). Diarsipkan dari versi asli tanggal 2 October 2011. Diakses tanggal 15 October 2013. Parameter
|url-status=yang tidak diketahui akan diabaikan (bantuan) - Schlöder, T.; Riedel, S. (2012). "Investigation of Heterodimeric and Homodimeric Radical Cations of the Series: [F2O2]+, [F2Cl2]+, [Cl2O2]+, [F4]+, and [Cl4]+". RSC Advances. Royal Society of Chemistry. 2 (3): 876–881. Bibcode:2012RSCAd...2..876S. doi:10.1039/C1RA00804H.
- Schmedt Auf Der Günne, Jörn; Mangstl, Martin; Kraus, Florian (2012). "Occurrence of Difluorine F2 in Nature-In Situ Proof and Quantification by NMR Spectroscopy". Angewandte Chemie International Edition. 51 (31): 7847–7849. doi:10.1002/anie.201203515. ISSN 1521-3773. PMID 22763992.
- Schmitz, A.; Kälicke, T.; Willkomm, P.; Grünwald, F.; Kandyba, J.; Schmitt, O. (2000). "Use of Fluorine-18 Fluoro-2-deoxy-D-glucose Positron Emission Tomography in Assessing the Process of Tuberculous Spondylitis" (PDF). Journal of Spinal Disorders. 13 (6): 541–544. doi:10.1097/00002517-200012000-00016. PMID 11132989. Diarsipkan (PDF) dari versi asli tanggal 2020-05-08. Diakses tanggal 8 October 2013.
- Schulze-Makuch, D.; Irwin, L. N. (2008). Life in the Universe: Expectations and Constraints (edisi ke-2nd). Berlin: Springer-Verlag. ISBN 978-3-540-76816-6.
- Schwarcz, Joseph A. (2004). The Fly in the Ointment: 70 Fascinating Commentaries on the Science of Everyday Life
 . Toronto: ECW Press. ISBN 1-55022-621-5.
. Toronto: ECW Press. ISBN 1-55022-621-5. - Senning, A. (2007). Elsevier's Dictionary of Chemoetymology: The Whies and Whences of Chemical Nomenclature and Terminology. Amsterdam and Oxford: Elsevier. ISBN 978-0-444-52239-9.
- Shaffer, T. H.; Wolfson, M. R.; Clark Jr, L. C. (1992). "Liquid Ventilation". Pediatric Pulmonology. 14 (2): 102–109. doi:10.1002/ppul.1950140208. PMID 1437347. Parameter
|s2cid=yang tidak diketahui akan diabaikan (bantuan) - Shin, Richard D.; Silverberg, Mark A. (2013). "Fluoride Toxicity". Medscape. Diarsipkan dari versi asli tanggal 2020-08-06. Diakses tanggal 15 October 2013.
- Shriver, Duward; Atkins, Peter (2010). Solutions Manual for Inorganic Chemistry. New York: W. H. Freeman. ISBN 978-1-4292-5255-3.
- Shulman, J. D.; Wells, L. M. (1997). "Acute Fluoride Toxicity from Ingesting Home-use Dental Products in Children, Birth to 6 Years of Age". Journal of Public Health Dentistry. 57 (3): 150–158. doi:10.1111/j.1752-7325.1997.tb02966.x. PMID 9383753.
- Siegemund, G. N.; Schwertfeger, W.; Feiring, A.; Smart, B.; Behr, F.; Vogel, H.; McKusick, B. (2005), "Fluorine Compounds, Organic", Ullmann's Encyclopedia of Industrial Chemistry, 15, Weinheim: Wiley-VCH, doi:10.1002/14356007.a11_349
- Slye, Orville M. (2012). "Fire Extinguishing Agents". Dalam Ullmann, Franz. Ullmann's Encyclopedia of Industrial Chemistry. 15. Weinheim: Wiley-VCH. hlm. 1–11. doi:10.1002/14356007.a11_113.pub2. ISBN 978-3527306732.
- Steenland, K.; Fletcher, T.; Savitz, D. A. (2010). "Epidemiologic Evidence on the Health Effects of Perfluorooctanoic Acid (PFOA)". Environmental Health Perspectives. 118 (8): 1100–1108. doi:10.1289/ehp.0901827. PMC 2920088
 . PMID 20423814.
. PMID 20423814. - Stillman, John Maxson (December 1912). "Basil Valentine, A Seventeenth Century Hoax". Popular Science Monthly. 81. Diarsipkan dari versi asli tanggal 2023-07-22. Diakses tanggal 14 October 2013.
- Storer, Frank H. (1864). First Outlines of a Dictionary of Solubilities of Chemical Substances. Cambridge: Sever and Francis.
- Swinson, Joel (June 2005). "Fluorine – A Vital Element in the Medicine Chest" (PDF). PharmaChem. Pharmaceutical Chemistry: 26–27. Diarsipkan dari versi asli (PDF) tanggal 8 February 2012. Diakses tanggal 9 October 2013. Parameter
|url-status=yang tidak diketahui akan diabaikan (bantuan) - Taber, Andrew (22 April 1999). "Dying to ride". Salon. Diarsipkan dari versi asli tanggal 2018-11-06. Diakses tanggal 18 October 2013.
- Tanner Industries (January 2011). "Anhydrous Ammonia: (MSDS) Material Safety Data Sheet". tannerind.com. Diarsipkan dari versi asli tanggal 2020-08-06. Diakses tanggal 24 October 2013.
- Theodoridis, George (2006). "Fluorine-Containing Agrochemicals: An Overview of Recent Developments". Dalam Tressaud, Alain. Fluorine and the Environment: Agrochemicals, Archaeology, Green Chemistry & Water. Amsterdam and Oxford: Elsevier. hlm. 121–176. ISBN 978-0-444-52672-4.
- Toon, Richard (1 September 2011). "The discovery of fluorine". Education in Chemistry. Vol. 48 no. 5. Royal Society of Chemistry. hlm. 148–151. ISSN 0013-1350.
- Transparency Market Research (17 May 2013). "Fluorochemicals Market is Expected to Reach USD 21.5 Billion Globally by 2018: Transparency Market Research". Transparency Market Research Blog. Diarsipkan dari versi asli tanggal 22 February 2014. Diakses tanggal 15 October 2013. Parameter
|url-status=yang tidak diketahui akan diabaikan (bantuan) - Ullmann, Fritz (2008). Ullmann's Fibers (2 volumes). Weinheim: Wiley-VCH. ISBN 978-3-527-31772-1.
- United States Environmental Protection Agency (1996). "R.E.D. Facts: Trifluralin" (PDF). Diarsipkan dari versi asli (PDF) tanggal 18 October 2013. Diakses tanggal 17 October 2013. Parameter
|url-status=yang tidak diketahui akan diabaikan (bantuan) - United States Environmental Protection Agency (2012). "Emerging Contaminants – Perfluorooctane Sulfonate (PFOS) and Perfluorooctanoic Acid (PFOA)" (PDF). Diarsipkan dari versi asli (PDF) tanggal 29 October 2013. Diakses tanggal 4 November 2013. Parameter
|url-status=yang tidak diketahui akan diabaikan (bantuan) - United States Environmental Protection Agency (2013a). "Class I Ozone-depleting Substances". Diarsipkan dari versi asli tanggal 10 December 2010. Diakses tanggal 15 October 2013. Parameter
|url-status=yang tidak diketahui akan diabaikan (bantuan) - United States Environmental Protection Agency (2013b). "Phaseout of HCFCs (Class II Ozone-Depleting Substances)". Diarsipkan dari versi asli tanggal 2015-09-24. Diakses tanggal 15 October 2013.
- Viel, Claude; Goldwhite, Harold (1993). "1906 Nobel Laureate: Henri Moissan, 1852–1907". Dalam Laylin, K. James. Nobel Laureates in Chemistry, 1901–1992. Washington: American Chemical Society; Chemical Heritage Foundation. hlm. 35–41. ISBN 978-0-8412-2690-6.
- Vigoureux, P. (1961). "The Gyromagnetic Ratio of the Proton". Contemporary Physics. 2 (5): 360–366. Bibcode:1961ConPh...2..360V. doi:10.1080/00107516108205282. Parameter
|s2cid=yang tidak diketahui akan diabaikan (bantuan) - Villalba, Gara; Ayres, Robert U.; Schroder, Hans (2008). "Accounting for Fluorine: Production, Use, and Loss". Journal of Industrial Ecology. 11: 85–101. doi:10.1162/jiec.2007.1075. Parameter
|s2cid=yang tidak diketahui akan diabaikan (bantuan) - Walsh, Kenneth A. (2009). Beryllium Chemistry and Processing. Materials Park: ASM International. ISBN 978-0-87170-721-5.
- Walter, P. (2013). "Honeywell Invests $300m in Green Refrigerant". Chemistry World. Diarsipkan dari versi asli tanggal 2016-03-04. Diakses tanggal 2022-08-04.
- Weeks, M. E. (1932). "The Discovery of the Elements. XVII. The Halogen Family". Journal of Chemical Education. 9 (11): 1915–1939. Bibcode:1932JChEd...9.1915W. doi:10.1021/ed009p1915.
- Werner, N. L.; Hecker, M. T.; Sethi, A. K.; Donskey, C. J. (2011). "Unnecessary use of Fluoroquinolone Antibiotics in Hospitalized Patients". BMC Infectious Diseases. 11: 187–193. doi:10.1186/1471-2334-11-187. PMC 3145580
 . PMID 21729289.
. PMID 21729289. - Wiberg, Egon; Wiberg, Nils; Holleman, Arnold Frederick (2001). Inorganic Chemistry. San Diego: Academic Press. ISBN 978-0-12-352651-9.
- Willey, Ronald R. (2007). Practical Equipment, Materials, and Processes for Optical Thin Films. Charlevoix: Willey Optical. ISBN 978-0-615-14397-2.
- Yaws, Carl L.; Braker, William (2001). "Fluorine". Matheson Gas Data Book (edisi ke-7th). Parsippany: Matheson Tri-Gas. ISBN 978-0-07-135854-5.
- Yeung, C. A. (2008). "A Systematic Review of the Efficacy and Safety of Fluoridation". Evidence-Based Dentistry. 9 (2): 39–43. doi:10.1038/sj.ebd.6400578
 . PMID 18584000.
. PMID 18584000. - Young, David A. (1975). Phase Diagrams of the Elements (Laporan). Lawrence Livermore Laboratory. Diakses tanggal 10 June 2011.
- Zareitalabad, P.; Siemens, J.; Hamer, M.; Amelung, W. (2013). "Perfluorooctanoic acid (PFOA) and perfluorooctanesulfonic acid (PFOS) in surface waters, sediments, soils and wastewater – A review on concentrations and distribution coefficients". Chemosphere. 91 (6): 725–32. Bibcode:2013Chmsp..91..725Z. doi:10.1016/j.chemosphere.2013.02.024. PMID 23498059.
- Zorich, Robert (1991). Handbook of Quality Integrated Circuit Manufacturing. San Diego: Academic Press. ISBN 978-0-323-14055-3.
Pranala luar
 Media terkait Fluorine di Wikimedia Commons
Media terkait Fluorine di Wikimedia Commons
| ||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||

















