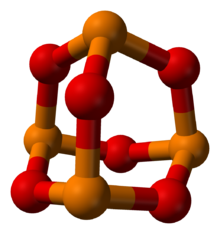
Trioxid de fosfor
| Trioxid de fosfor | |
 | |
 | |
| Identificare | |
|---|---|
SMILES O1P2OP3OP1OP(O2)O3[1]  | |
| Număr CAS | 12440-00-5 |
| PubChem CID | 123290 |
| Formulă chimică | O₆P₄[1]  |
| Masă molară | 220 u.a.m.[1]  |
| Proprietăți | |
| Densitate | 2 g/cm³  |
| Punct de topire | 24 °C  |
| Sunt folosite unitățile SI și condițiile de temperatură și presiune normale dacă nu s-a specificat altfel. | |
Modifică date / text  | |
Trioxidul de fosfor este un compus chimic cu formula P4O6. Numele său comun este derivat de la formula empirică (sau brută), P2O3. Este un solid alb, cristalin, de consistența cerii, fiind anhidrida acidului fosforos (de aceea, mai poate fi numită și anhidridă fosforoasă), însă nu poate fi obținut prin deshidratarea acestuia. [2][3]
Obținere
Pentoxidul de fosfor se obține prin oxidarea lentă fosforului alb cu o cantitate insuficientă de aer, la temperatură joasă:[2]
- P4(s) + 3 O2(g) → P4O6(s)
Prin expunerea la lumină, se poate descompune la fosfor roșu, și de asemenea se mai pot obține produși secundari de reacție, precum suboxidul de fosfor, roșu.[3]
Proprietăți chimice
Reacția de hidratare
Trioxidul de fosfor reacționează cu apa rece formând acidul fosforos, ceea ce subliniază caracterul de anhidridă a acestui acid.[4][5]
- P4O6 + 6 H2O → 4 H3PO3
În reacția cu apa caldă, dă produșii de descompunere ai acidului fosforos, anume acidul fosforic, hidrogenul fosforat și eventual fosfor elementar:[2]
- 4 H3PO4 → PH3 + 3 H3PO4
Caracterul reducător
La o temperatură de aproximativ 50-60°C, trioxidul de fosfor se oxidează cu formarea de pentoxid de fosfor:
În reacția cu clorul sau cu bromul, formează halogenura de fosforil corespunzătoare, iar cu iodul într-un tub închis formează tetraiodură de difosfor:[3]
Alte reacții
Trioxidul de fosfor reacționează cu acidul clorhidric cu formarea de acid fosforos și triclorură de fosfor:
- P4O6 + 6 HCl → 2 H3PO3 + 2 PCl3
Când P4O6 reacționează cu ozonul, la o temperatură de 195 K în mediu de diclorometan, se formează un compus al fosforului, extrem de instabil, cu formula P4O18:[6]
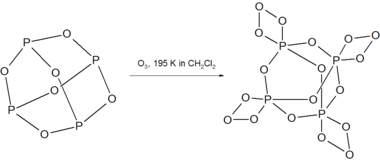
Vezi și
Referințe
- ^ a b c „Trioxid de fosfor”, Tetraphosphorus hexaoxide (în engleză), PubChem, accesat în
- ^ a b c Nenițescu, Costin D. Chimie generală. București: Editura Didactică și Pedagogică. pp. 757–758.
- ^ a b c A. F. Holleman; Wiberg, Egon; Wiberg, Nils (). Inorganic Chemistry. Boston: Academic Press. ISBN 0-12-352651-5.
- ^ Ripan, Ceteanu, op. cit., p. 355
- ^ Greenwood, Norman N.; Earnshaw, Alan (). Chemistry of the Elements (ed. 2nd). Oxford: Butterworth-Heinemann. ISBN 0080379419. Mentenanță CS1: Nume multiple: lista autorilor (link)
- ^ .Catherine E. Housecroft; Alan G. Sharpe (). „Chapter 15: The group 15 elements”. Inorganic Chemistry, 3rd Edition. Pearson. p. 473. ISBN 978-0-13-175553-6.
| ||||||||||||||||||||||||||||||||||||||














