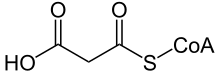
Malonil-CoA

| Malonil-CoA | |
|---|---|
 | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C24H38N7O19P3S |
| Massa molecolare (u) | 853.582 |
| Numero CAS | 524-14-1 |
| Numero EINECS | 208-353-4 |
| PubChem | 644066 |
| DrugBank | DBDB04524 |
| SMILES | CC(C)(COP(=O)(O)OP(=O)(O)OCC1C(C(C(O1)N2C=NC3=C2N=CN=C3N)O)OP(=O)(O)O)C(C(=O)NCCC(=O)NCCSC(=O)CC(=O)O)O |
| Indicazioni di sicurezza | |
| Frasi H | --- |
| Consigli P | ---[1] |
| Modifica dati su Wikidata · Manuale | |
Il malonil-CoA è una molecola derivata dal coenzima A che si forma grazie ad una reazione di carbossilazione tra l'acetil-coenzima A e lo ione bicarbonato (HCO3-) catalizzata dalla acetil-CoA carbossilasi in presenza di ATP. Il coenzima A risulta dunque legato, mediante legame tiosterico, ad un'unità a 3 atomi di Carbonio (un malonile).
Funzioni
Esso svolge un ruolo fondamentale nella biosintesi degli acidi grassi, processo che avviene nel citosol cellulare (in particolare nelle cellule del fegato, del tessuto adiposo e delle ghiandole mammarie) e nei mitocondri.
Il malonil-CoA è anche utilizzato nel trasporto dell'alfa-chetoglutarato attraverso la membrana del mitocondrio.
Biosintesi citosolica degli acidi grassi
Il malonil CoA è il principale fornitore di unità acetiliche nella sintesi degli acidi grassi. Delle otto unità che servono per la sintesi del palmitato, ad esempio, ben sette sono fornite dal malonil-CoA e soltanto una dall'acetil-CoA (quella iniziale). Il malonil-CoA può quindi essere considerato come il vero precursore di tutti gli atomi di carbonio di un acido grasso. I due atomi di carbonio forniti dall'acetil-CoA servono dunque da innesco della biosintesi e vanno a costituire l'estremità terminale della catena dell'acido grasso, da cui partirà poi l'allungamento e l'estensione della catena. In questa reazione vengono rilasciate sette molecole di CO2 ed il potere riducente viene fornito solo ed esclusivamente dal NADPH.
La reazione è catalizzata dalla (proteina trasportante acili) S-maloniltransferasi (MCAT), che trasferisce il malonile dal malonil-CoA al tiolo terminale della proteina trasportante acili (ACP), grazie ad un enzima chiamato malonil-transferasi.
Biosintesi mitocondriale degli acidi grassi
Il malonil-CoA si forma nella prima fase della sintesi mitocondriale degli acidi grassi (mtFASII) a partire dall'acido malonico ad opera della malonil-CoA sintetasi (ACSF3).[2][3]
Malattie
Il malonil-CoA svolge un ruolo particolare nella clearance mitocondriale dell'acido malonico tossico nel disturbo metabolico dell'aciduria combinata malonica e metilmalonica (CMAMMA).[4] Nella CMAMMA, a causa del deficit di ACSF3, è diminuita la malonil-CoA sintetasi, che può generare malonil-CoA dall'acido malonico, che a sua volta viene convertito in acetil-CoA dalla malonil-CoA decarbossilasi.[4][2] Nella CMAMMA, invece, a causa del deficit di malonil-CoA decarbossilasi, la malonil-CoA decarbossilasi, che converte il malonil-CoA in acetil-CoA, è ridotta.[4]
Note
- ^ Sigma Aldrich; rev. del 09.07.2012, riferita al sale di litio
- ^ a b (EN) Andrzej Witkowski, Jennifer Thweatt e Stuart Smith, Mammalian ACSF3 Protein Is a Malonyl-CoA Synthetase That Supplies the Chain Extender Units for Mitochondrial Fatty Acid Synthesis, in Journal of Biological Chemistry, vol. 286, n. 39, 2011-09, pp. 33729–33736, DOI:10.1074/jbc.M111.291591.
- ^ (EN) Caitlyn E. Bowman, Susana Rodriguez e Ebru S. Selen Alpergin, The Mammalian Malonyl-CoA Synthetase ACSF3 Is Required for Mitochondrial Protein Malonylation and Metabolic Efficiency, in Cell Chemical Biology, vol. 24, n. 6, 2017-06, pp. 673–684.e4, DOI:10.1016/j.chembiol.2017.04.009.
- ^ a b c (EN) Caitlyn E. Bowman e Michael J. Wolfgang, Role of the malonyl-CoA synthetase ACSF3 in mitochondrial metabolism, in Advances in Biological Regulation, vol. 71, 2019-01, pp. 34–40, DOI:10.1016/j.jbior.2018.09.002.
Voci correlate
Collegamenti esterni
- (EN) malonyl coenzyme A, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.

 Portale Biologia
Portale Biologia Portale Chimica
Portale Chimica![{\displaystyle \mathrm {Acido\ malonico+CoA+ATP\ {\xrightarrow[{ACSF3}]{Malonil{-}CoA\ sintetasa}}\ Malonil{-}CoA\ {\xrightarrow[{MLYCD}]{Malonil-CoA\ decarbossilasa}}\ Acetil{-}CoA} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/2bac7f3ba7750ed25f3d332040a03fcf49b45ef1)









