Smad 4
| SMAD4 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Identifiants | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Aliases | SMAD4 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| IDs externes | OMIM: 600993 MGI: 894293 HomoloGene: 31310 GeneCards: SMAD4 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Wikidata | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Smad4 ou Mothers against decapentaplegic homolog 4 est une protéine qui contient 552 acides aminés.
Description de la protéine
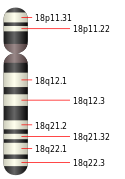





Elle est codée par le chromosome 18 humain plus précisément dans la région 18q21.1. Le poids de celle-ci est de 60439 Da. Le nom Smad vient de deux protéines, MAD qui provient de la drosophile et SMA qui est une protéine venant du nématode C.elegans. Pendant les études faites sur la drosophile, certains chercheurs ont découvert une mutation dans le gène MAD. Cette mutation était transmise par la mère drosophile à son embryon sous forme de « décapentaplégie », c’est-à-dire une forme de paralysie. C'est pour cette raison que la protéine Smad signifie « similaire mère contre décapentaplégie »[5]. Il y a aussi d’autres noms que certains auteurs donne à cette protéine comme : DPC4, JIP, MAD, MADH4.
Smad 4 fait partie de la taxonomie des Homo sapiens. Elle est omniprésente dans les cellules de la peau, du pancréas, du colon, de l’utérus, de l’épithélium ainsi que par les fibroblastes. Elle possède aussi deux sites de sumoylation, un majeur positionné sur la lysine 159 et un mineur sur la lysine 113. L’addition d’une protéine SUMO augmente la stabilité de Smad 4.
Smad 4 fait partie de la famille des Smads. Elle joue le rôle de transduction de signal et de facteur de transcription. Elle se localise dans le cytoplasme de la cellule et se transporte dans le noyau afin d’y effectuer son action. On peut donc affirmer que cette protéine est une effectrice intracellulaire.
Mécanisme d'action de Smad 4
Le ligand respectif vient se lier sur le récepteur Smads qui est un récepteur sérine/thréonine kinase. Ensuite, Smad 2 et Smad 3 sont phosphorylés en raison de l’activation du récepteur de type 1. Il y aura par la suite formation d’un complexe avec le smad 4. Ce complexe hétérodimérique de Smad 4 et de Smads est transloqué dans le noyau où il pourra réguler la transcription de gènes spécifiques impliqués dans le contrôle et la régulation de la croissance cellulaire. En résumé, la protéine Smad 4 est primordiale dans la régulation de la croissance cellulaire via la voie du TGF- β[6],[7].Les différentes étapes du mécanisme d'action sont illustrées sur le côté.
En médecine
Les pathologies associées à cette protéine sont en lien avec le TGF- β. S’il y a une mutation dans le gène codant la protéine Smad 4, la transcription du TGF- β ne se fera pas, donc il y aura une croissance cellulaire sans inhibition. Cette croissance entraînera l’apparition de tumeur et de certains cancers à plus long terme. Par exemple, étant donné que la protéine Smad 4 est présente dans les cellules du pancréas et du colon, il y aura donc possibilité de développer un cancer colorectal ou un carcinome pancréatique[8]. Une délétion dans le gène de cette protéine peut entraîner l’inactivation de Smad 4 et, par conséquent, entraîner un cancer du sein. Le syndrome de la polypose juvénile[9] ou une maladie de Rendu-Osler[10] peuvent aussi être la conséquence d’une mutation de SMAD4. Des variants du gène sont associées avec le risque de survenue d'un anévrisme de l'aorte thoracique[11].
Autre exemple de pathologie en lien avec un virus
Le VPH, virus du papillome humain, fait partie de la famille des papovavirus. Le virus du papillome humain exprime une oncoprotéine E7. Cette oncoprotéine est impliquée dans la cause de cancers cervicaux associés à l’infection du VPH.
Premièrement, l’oncoprotéine vient se lier soit à Smad 1,2,3 et 4. Cela entraînera un blocage dans l’interaction du complexe Smad[12]. Ce complexe ne pourra donc plus se transloquer dans le noyau et engendrer la transcription du TGF- β. S’il n’y a plus de formation de TGF- β, la cellule va continuer de croître puisqu’elle n’aura plus de signal d’inhibition. Il y aura donc développement d’une tumeur et à plus long terme, d’un cancer.
Notes et références
- ↑ a b et c GRCh38: Ensembl release 89: ENSG00000141646 - Ensembl, May 2017
- ↑ a b et c GRCm38: Ensembl release 89: ENSMUSG00000024515 - Ensembl, May 2017
- ↑ « Publications PubMed pour l'Homme », sur National Center for Biotechnology Information, U.S. National Library of Medicine
- ↑ « Publications PubMed pour la Souris », sur National Center for Biotechnology Information, U.S. National Library of Medicine
- ↑ Dr.Xin-Hua Feng, SUMO-1 modification in Smad 4/DPC4, Houston, JBC Papers in Press, 2003
- ↑ Massague J, Wotton D, Transcriptional control by the TGF-beta/Smad signaling system, EMBO J, 2000
- ↑ Roelen BA, Phosphorylation of threonine 276 in SMAD4 is involved in TGF-B induced nuclear accumulation, Boston, 2003
- ↑ Kitamura T, SMAD4-deficient intestinal tumors recruit CCR1, E pub, Kyoto, 2007
- ↑ Chow E, Macrae F, A review of juvenile polyposis syndrome, J. Gastroenterol Hepatol, 2005
- ↑ Gallione CJ, Repetto GM, Legius E et al. A combined syndrome of juvenile polyposis and hereditary haemorrhagic telangiectasia associated with mutations in MADH4 (SMAD4), Lancet, 2004;363:852-859
- ↑ Teekakirikul P, Milewicz DM, Miller DT et al. Thoracic aortic disease in two patients with juvenile polyposis syndrome and SMAD4 mutations, Am J Med Genet A, 2013;161A:185-191
- ↑ Dug Keun Lee, The human papilloma virus E7 […], Houston, JBC Papers in Press, 2002
Lien interne
v · m | |||||||
|---|---|---|---|---|---|---|---|
| Superfamille TGF beta |
| ||||||
| TGFBR (ACVR, BMPR, Famille) |
| ||||||
| Transducteurs/SMAD | |||||||
| Inhibiteurs de ligands | |||||||
| Corécepteur |
| ||||||
| Autres |
| ||||||
 Portail de la biologie cellulaire et moléculaire
Portail de la biologie cellulaire et moléculaire  Portail de la médecine
Portail de la médecine

















