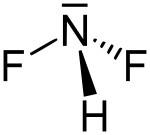
Difluoramin
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Difluoramin | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | HNF2 | ||||||||||||
| Kurzbeschreibung | farbloses Gas[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 53,01 g·mol−1 | ||||||||||||
| Aggregatzustand | gasförmig | ||||||||||||
| Dichte | 1,424 g·cm−3[2] | ||||||||||||
| Schmelzpunkt | −116,4 °C[1] | ||||||||||||
| Siedepunkt | −23,6 °C[1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Difluoramin ist eine chemische Verbindung aus der Gruppe der Stickstoffhalogenide.
Gewinnung und Darstellung
Difluoramin kann durch Hydrolyse von N,N-Difluorharnstoff gewonnen werden.[4]
Auch die Herstellung durch Spaltung von Tetrafluorhydrazin mit Thiophenol ist möglich.[1]
Es entsteht auch als Beiprodukt bei der Reduktion von Stickstofftrifluorid mit Arsen oder der Fluorierung von Harnstoff.[4] Ebenso (wie andere Stickstoffhalogenide) entsteht es bei der Elektrolyse von Ammoniumhydrogendifluorid.[1]
Eigenschaften
Difluoramin ist ein explosives farbloses Gas, das 1931 durch Otto Ruff entdeckt wurde. Es stellt eine Säure dar und reagiert mit Basen unter Bildung des Difluoramid-Ions NF2− Das Molekül besitzt eine pyramidale Struktur mit dem Stickstoff an der Spitze. Bei Anwesenheit von Kaliumfluorid zersetzt es sich in Difluordiimin und Fluorwasserstoff.[1]
Weblinks
- R. J. Douthart, J. N. Keith, W. K. Sumida: Reactions of difluoramine with lewis acids, doi:10.1021/ba-1966-0054.ch014
Einzelnachweise
- ↑ a b c d e f A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 91.–100., verbesserte und stark erweiterte Auflage. Walter de Gruyter, Berlin 1985, ISBN 3-11-007511-3, S. 571–576.
- ↑ Emil A. Lawton, John Q. Weber: The direct fluorination of urea: the synthesis and properties of difluoramine, J. Am. Chem. Soc., 1959, 81 (17), pp 4755–4755, doi:10.1021/ja01526a087.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b C-O. Parker, J.P. Freeman: Inorganic Syntheses. 2009, ISBN 978-0-470-13278-4, S. 307 (englisch, eingeschränkte Vorschau in der Google-Buchsuche).















